Wie Berechnet Man Den Ph Wert

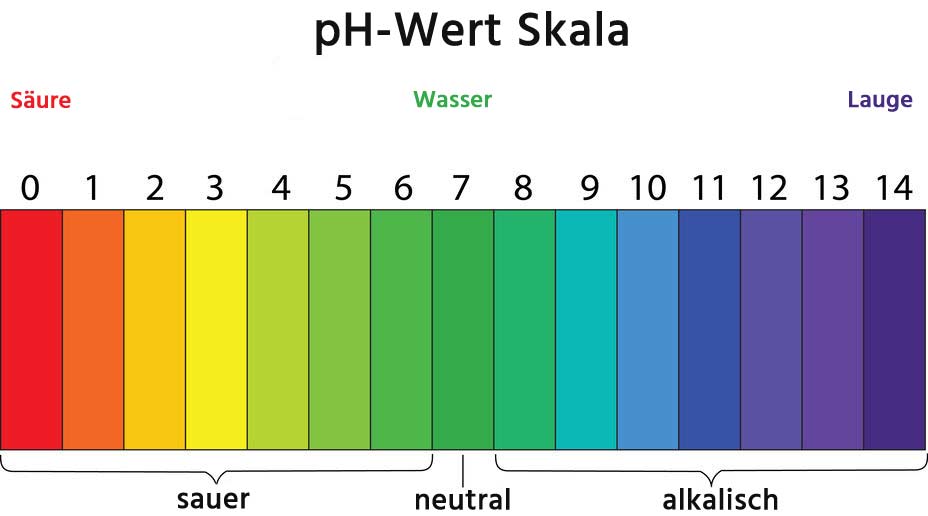
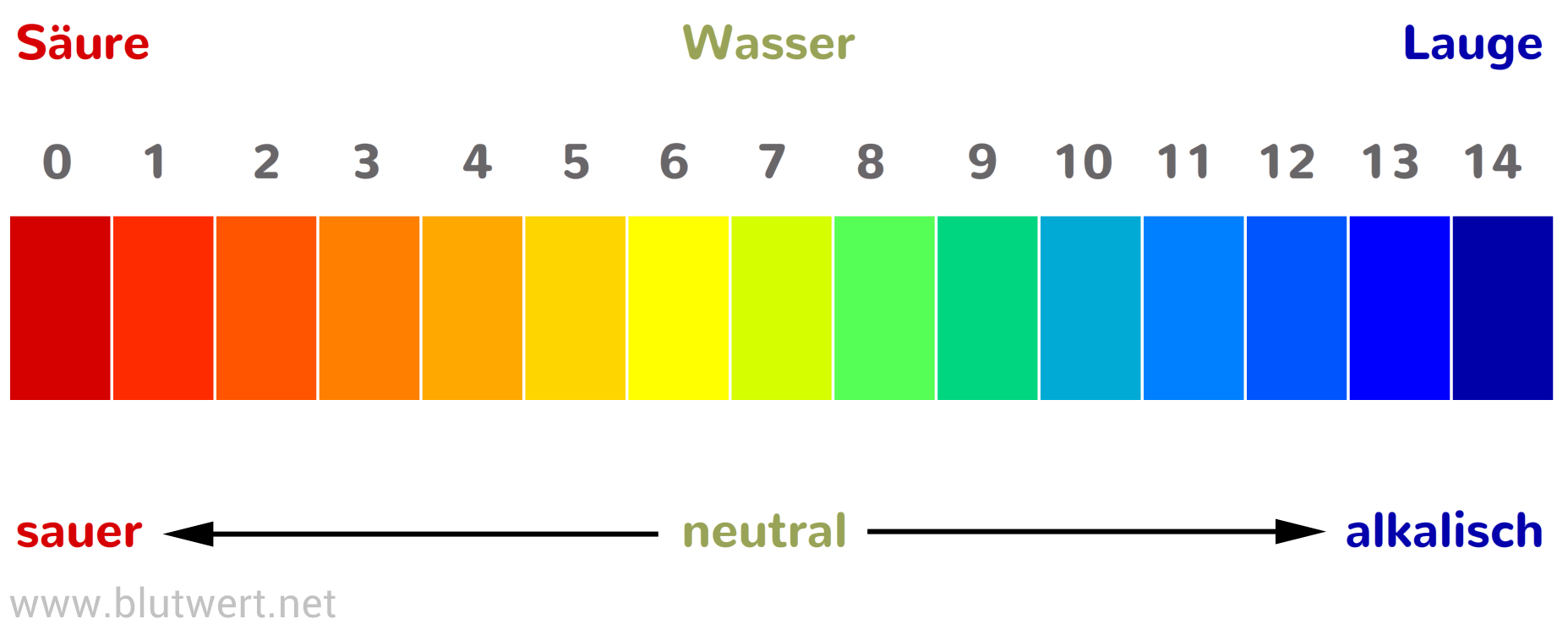
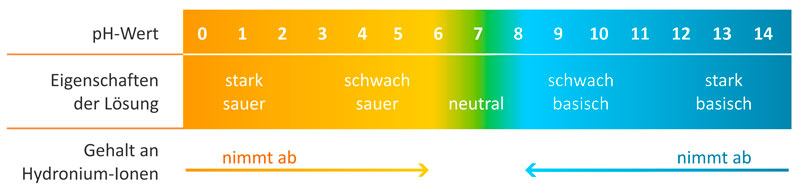
Der pH-Wert ist ein Maß für die Acidität oder Basizität einer wässrigen Lösung. Er gibt an, wie sauer oder alkalisch eine Flüssigkeit ist. Die pH-Skala reicht von 0 bis 14, wobei:
- pH < 7: Saure Lösung
- pH = 7: Neutrale Lösung
- pH > 7: Alkalische oder basische Lösung
Die Kenntnis des pH-Werts ist in vielen Bereichen wichtig, von der Chemie und Biologie bis hin zur Landwirtschaft und im Alltag (z.B. bei der Wasserqualität oder der Verwendung von Reinigungsmitteln).
Die Grundlagen: Was ist der pH-Wert genau?
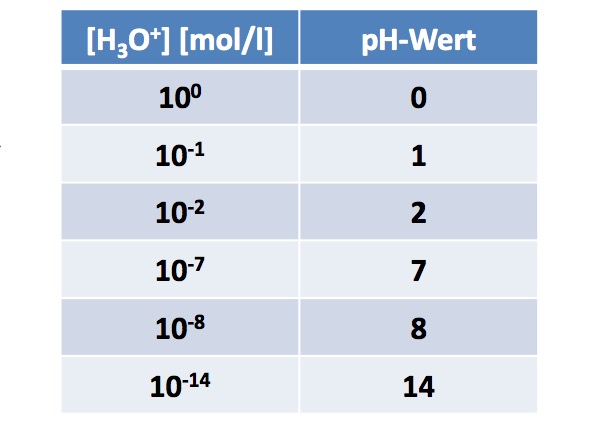
Der pH-Wert basiert auf der Konzentration von Hydroniumionen (H3O+) in einer Lösung. Vereinfacht gesagt, ist er der negative dekadische Logarithmus der Hydroniumionenkonzentration:
pH = -log10[H3O+]
Die Konzentration wird üblicherweise in Mol pro Liter (mol/L) angegeben. Eine höhere Konzentration an Hydroniumionen bedeutet einen niedrigeren pH-Wert und somit eine saure Lösung. Umgekehrt bedeutet eine niedrigere Konzentration an Hydroniumionen einen höheren pH-Wert und somit eine basische Lösung.
In reinem Wasser dissoziieren Wasserstoff- und Hydroxid-Ionen (OH-) in geringem Umfang. Bei 25°C beträgt die Konzentration von H3O+ und OH- jeweils 10-7 mol/L. Daher ist der pH-Wert von reinem Wasser 7, was als neutral gilt.
Wie berechnet man den pH-Wert?
Es gibt verschiedene Methoden, um den pH-Wert zu berechnen oder zu bestimmen, abhängig davon, welche Informationen vorliegen.
1. Berechnung bei bekannter Hydroniumionenkonzentration:
Wenn die Hydroniumionenkonzentration [H3O+] bekannt ist, kann der pH-Wert direkt mit der oben genannten Formel berechnet werden:
pH = -log10[H3O+]
Beispiel: Angenommen, die Hydroniumionenkonzentration einer Lösung beträgt 0,001 mol/L (10-3 mol/L). Dann ist der pH-Wert:
pH = -log10(10-3) = -(-3) = 3
Die Lösung ist also sauer.
2. Berechnung bei bekannter pOH-Wert:
Der pOH-Wert ist analog zum pH-Wert, aber er bezieht sich auf die Konzentration von Hydroxidionen (OH-). Der pOH-Wert wird definiert als:
pOH = -log10[OH-]
Der pH-Wert und der pOH-Wert sind durch folgende Beziehung miteinander verbunden:
pH + pOH = 14 (bei 25°C)
Wenn also der pOH-Wert bekannt ist, kann der pH-Wert berechnet werden als:
pH = 14 - pOH
Beispiel: Wenn der pOH-Wert einer Lösung 4 beträgt, dann ist der pH-Wert:
pH = 14 - 4 = 10
Die Lösung ist also basisch.
3. Berechnung bei schwachen Säuren und Basen:
Die Berechnung des pH-Werts für schwache Säuren und Basen ist etwas komplexer, da diese in wässriger Lösung nicht vollständig dissoziieren. Man muss die Säurekonstante (Ka) oder die Basenkonstante (Kb) berücksichtigen.
a) Schwache Säuren:
Für eine schwache Säure HA gilt das folgende Gleichgewicht:
HA + H2O ⇌ H3O+ + A-
Die Säurekonstante Ka ist definiert als:
Ka = [H3O+][A-] / [HA]
Um den pH-Wert zu berechnen, muss man zunächst die Hydroniumionenkonzentration [H3O+] bestimmen. Dies geschieht in der Regel durch die Aufstellung einer Reaktionslaufzahl (ICE-Tabelle) und die Lösung einer quadratischen Gleichung (oder durch Annäherungen, wenn die Dissoziation sehr gering ist).
Näherungsweise Berechnung: Wenn die Säure sehr schwach ist (Ka ist klein) und die Konzentration der Säure ausreichend hoch ist, kann man die folgende Näherung verwenden:
[H3O+] ≈ √(Ka * [HA]0)
wobei [HA]0 die Anfangskonzentration der Säure ist.
Dann kann der pH-Wert berechnet werden als:
pH = -log10[H3O+]
b) Schwache Basen:
Für eine schwache Base B gilt das folgende Gleichgewicht:
B + H2O ⇌ BH+ + OH-
Die Basenkonstante Kb ist definiert als:
Kb = [BH+][OH-] / [B]
Die Berechnung des pH-Werts erfolgt ähnlich wie bei schwachen Säuren, wobei zuerst die Hydroxidionenkonzentration [OH-] bestimmt wird. Auch hier kann man eine Reaktionslaufzahl aufstellen oder, wenn die Base sehr schwach ist, die folgende Näherung verwenden:
[OH-] ≈ √(Kb * [B]0)
wobei [B]0 die Anfangskonzentration der Base ist.
Dann kann der pOH-Wert berechnet werden als:
pOH = -log10[OH-]
Und schließlich der pH-Wert:
pH = 14 - pOH
4. Messung mit pH-Meter oder Indikatoren:
Neben der Berechnung gibt es auch experimentelle Methoden zur Bestimmung des pH-Werts:
- pH-Meter: Ein pH-Meter ist ein elektronisches Gerät, das den pH-Wert einer Lösung sehr genau messen kann. Es besteht aus einer Glaselektrode und einer Bezugselektrode, die in die Lösung eingetaucht werden. Das Messgerät zeigt dann den pH-Wert direkt an.
- pH-Indikatoren: pH-Indikatoren sind Substanzen, die ihre Farbe in Abhängigkeit vom pH-Wert ändern. Es gibt verschiedene pH-Indikatoren, die in unterschiedlichen pH-Bereichen ihre Farbe ändern. Man kann Indikatorpapier oder flüssige Indikatoren verwenden. Indikatorpapier wird in die Lösung getaucht, und die resultierende Farbe wird mit einer Farbkarte verglichen, um den pH-Wert zu bestimmen.
Wichtige Hinweise:
- Temperatur: Der pH-Wert ist temperaturabhängig. Die obigen Berechnungen und Beziehungen gelten in der Regel für eine Temperatur von 25°C. Bei anderen Temperaturen können sich die Werte leicht ändern.
- Ionenstärke: Die Ionenstärke der Lösung kann ebenfalls den pH-Wert beeinflussen. Bei hohen Ionenstärken können Abweichungen von den idealen Berechnungen auftreten.
- Genauigkeit: Die Genauigkeit der pH-Wert-Bestimmung hängt von der Methode ab. pH-Meter sind in der Regel genauer als pH-Indikatoren. Bei Berechnungen mit Näherungen muss man sich der möglichen Fehler bewusst sein.
Zusammenfassend lässt sich sagen, dass die Berechnung des pH-Werts von der Art der vorliegenden Substanz und den verfügbaren Informationen abhängt. Für starke Säuren und Basen ist die Berechnung einfach, wenn die Konzentration bekannt ist. Für schwache Säuren und Basen sind komplexere Berechnungen erforderlich, die die Säure- oder Basenkonstante berücksichtigen. Die Verwendung von pH-Metern oder Indikatoren ist eine praktische Möglichkeit, den pH-Wert experimentell zu bestimmen.

![Wie Berechnet Man Den Ph Wert pH Wert • Definition, Skala, Tabelle, Bedeutung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/04/pH-Wert-Farbskala-1024x576.png)








![Wie Berechnet Man Den Ph Wert pH-Wert einfach erklärt • Skala und Bedeutung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/11/pH-Wert-Thumbnail-1024x576.png)