Wie Berechnet Man Die Stoffmenge

Die Stoffmenge ist eine fundamentale Größe in der Chemie, die angibt, wie viele Teilchen (Atome, Moleküle, Ionen oder andere definierte Einheiten) in einer bestimmten Probe vorhanden sind. Sie wird in der Einheit Mol (mol) gemessen. Ein Mol entspricht genau 6,02214076 × 1023 Teilchen. Diese Zahl wird als Avogadro-Konstante (NA) bezeichnet. Das Verständnis, wie man die Stoffmenge berechnet, ist entscheidend für viele chemische Berechnungen, wie z.B. die Bestimmung von Reaktionsverhältnissen, die Herstellung von Lösungen mit definierter Konzentration und die Analyse von chemischen Substanzen.
Grundlagen der Stoffmengenberechnung
Die Stoffmenge (n) einer Substanz kann auf verschiedene Arten berechnet werden, abhängig davon, welche Informationen gegeben sind. Die häufigsten Methoden sind:
1. Berechnung über die Masse (m) und die molare Masse (M)
Wenn die Masse einer Substanz bekannt ist, kann die Stoffmenge mithilfe der molaren Masse berechnet werden. Die molare Masse (M) ist die Masse eines Mols einer Substanz und wird in Gramm pro Mol (g/mol) angegeben. Sie entspricht numerisch der Atom- oder Molekülmasse, die im Periodensystem oder durch Addition der Atommassen im Molekül ermittelt wird.
Die Formel zur Berechnung der Stoffmenge über Masse und molare Masse lautet:
n = m / M
wobei:
- n = Stoffmenge (in Mol)
- m = Masse der Substanz (in Gramm)
- M = molare Masse der Substanz (in Gramm pro Mol)
Beispiel: Berechnen Sie die Stoffmenge von 10 Gramm Natriumchlorid (NaCl). Die molare Masse von Natrium (Na) beträgt 22,99 g/mol und die molare Masse von Chlor (Cl) beträgt 35,45 g/mol. Die molare Masse von NaCl ist somit 22,99 + 35,45 = 58,44 g/mol.
n = 10 g / 58,44 g/mol = 0,171 mol
Das bedeutet, dass 10 Gramm Natriumchlorid 0,171 Mol entsprechen.
2. Berechnung über die Anzahl der Teilchen (N) und die Avogadro-Konstante (NA)
Wenn die Anzahl der Teilchen (Atome, Moleküle, Ionen) in einer Probe bekannt ist, kann die Stoffmenge mithilfe der Avogadro-Konstante berechnet werden. Wie bereits erwähnt, beträgt die Avogadro-Konstante ungefähr 6,022 × 1023 Teilchen pro Mol.
Die Formel zur Berechnung der Stoffmenge über die Anzahl der Teilchen lautet:
n = N / NA
wobei:
- n = Stoffmenge (in Mol)
- N = Anzahl der Teilchen
- NA = Avogadro-Konstante (6,022 × 1023 Teilchen/mol)
Beispiel: Berechnen Sie die Stoffmenge, die 1,2044 × 1024 Sauerstoffatome (O) entsprechen.
n = (1,2044 × 1024 Atome) / (6,022 × 1023 Atome/mol) = 2 mol
Das bedeutet, dass 1,2044 × 1024 Sauerstoffatome 2 Mol entsprechen.
3. Berechnung über das Volumen (V) für Gase bei Standardbedingungen (STP)
Für Gase, die sich unter Standardbedingungen (STP) befinden (0 °C oder 273,15 K und 101,325 kPa Druck), kann die Stoffmenge über das Volumen berechnet werden. Unter STP nimmt ein Mol eines idealen Gases ein Volumen von 22,4 Litern ein. Dieses Volumen wird als molares Volumen (Vm) bezeichnet.
Die Formel zur Berechnung der Stoffmenge über das Volumen bei STP lautet:
n = V / Vm
wobei:
- n = Stoffmenge (in Mol)
- V = Volumen des Gases (in Litern)
- Vm = molares Volumen (22,4 Liter/mol bei STP)
Beispiel: Berechnen Sie die Stoffmenge von 44,8 Litern Sauerstoffgas (O2) bei STP.
n = 44,8 L / 22,4 L/mol = 2 mol
Das bedeutet, dass 44,8 Liter Sauerstoffgas bei STP 2 Mol entsprechen.
4. Berechnung über die Konzentration (c) und das Volumen (V) für Lösungen
Für Lösungen kann die Stoffmenge eines gelösten Stoffes über die Konzentration und das Volumen der Lösung berechnet werden. Die Konzentration (c) gibt an, wie viel gelöster Stoff in einer bestimmten Menge Lösung enthalten ist. Die üblichste Einheit für die Konzentration ist Mol pro Liter (mol/L), auch als Molarität (M) bezeichnet.
Die Formel zur Berechnung der Stoffmenge über die Konzentration und das Volumen lautet:
n = c * V
wobei:
- n = Stoffmenge (in Mol)
- c = Konzentration der Lösung (in Mol/L)
- V = Volumen der Lösung (in Litern)
Beispiel: Berechnen Sie die Stoffmenge von Natriumhydroxid (NaOH) in 250 ml einer 0,5 M NaOH-Lösung.
Zuerst muss das Volumen in Liter umgerechnet werden: 250 ml = 0,25 L
n = 0,5 mol/L * 0,25 L = 0,125 mol
Das bedeutet, dass 250 ml einer 0,5 M NaOH-Lösung 0,125 Mol Natriumhydroxid enthalten.
Wichtige Hinweise und Tipps
- Einheiten beachten: Achten Sie immer auf die Einheiten der gegebenen Größen und stellen Sie sicher, dass sie in die richtigen Einheiten für die Formel umgerechnet werden (z.B. ml in L, g in kg).
- Molare Masse korrekt bestimmen: Berechnen Sie die molare Masse korrekt, indem Sie die Atomgewichte der einzelnen Elemente im Molekül aus dem Periodensystem addieren.
- Standardbedingungen (STP) kennen: Merken Sie sich die Standardbedingungen für Temperatur und Druck (0 °C und 101,325 kPa), wenn Sie mit Gasen rechnen.
- Ideales Gasgesetz: Wenn die Bedingungen von STP abweichen, verwenden Sie das ideale Gasgesetz (pV = nRT), um die Stoffmenge zu berechnen. (p = Druck, V = Volumen, n = Stoffmenge, R = ideale Gaskonstante, T = Temperatur in Kelvin).
- Genauigkeit: Achten Sie auf die Anzahl der signifikanten Stellen in Ihren Berechnungen, um die Genauigkeit Ihrer Ergebnisse zu gewährleisten.
- Formeln verstehen: Es ist wichtiger, die Konzepte hinter den Formeln zu verstehen, als sie einfach nur auswendig zu lernen. Verstehen Sie, warum jede Formel funktioniert und wann sie anzuwenden ist.
- Üben: Übung macht den Meister! Lösen Sie so viele Übungsaufgaben wie möglich, um Ihr Verständnis zu festigen und Ihre Fähigkeiten zu verbessern.
Zusammenfassung
Die Berechnung der Stoffmenge ist eine grundlegende Fähigkeit in der Chemie. Indem Sie die oben genannten Methoden verstehen und anwenden, können Sie Stoffmengen aus Masse, Anzahl der Teilchen, Volumen von Gasen und Konzentration von Lösungen berechnen. Achten Sie auf die Einheiten, bestimmen Sie die molare Masse korrekt und üben Sie regelmäßig, um Ihre Fähigkeiten zu verbessern. Mit diesen Kenntnissen sind Sie bestens gerüstet, um chemische Rechnungen erfolgreich durchzuführen.

![Wie Berechnet Man Die Stoffmenge Stoffmengekonzentration • Formel und Berechnung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2022/05/Stoffmengenkonzentration--1024x576.jpg)

![Wie Berechnet Man Die Stoffmenge Wie kann ich die Stoffmenge berechnen? [Tipps]](https://images.cdn.sofatutor.net/content_images/images/6951/normal/waage-mit-blei-und-schwefel.jpg?1599212250)
![Wie Berechnet Man Die Stoffmenge Wie kann ich die Stoffmenge berechnen? [Tipps]](https://images.cdn.sofatutor.net/videos/pictures/15623/normal/15623_TESTPAKET_Einheiten_der_Chemie_(Vorschaubild).jpg?1394457633)
![Wie Berechnet Man Die Stoffmenge Stoffmengekonzentration • Formel und Berechnung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2018/12/Stoffmengen-und-Konzentrationen-Übungsaufgabe-Thumbnail-1024x576.png)

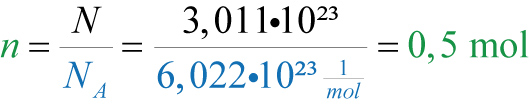

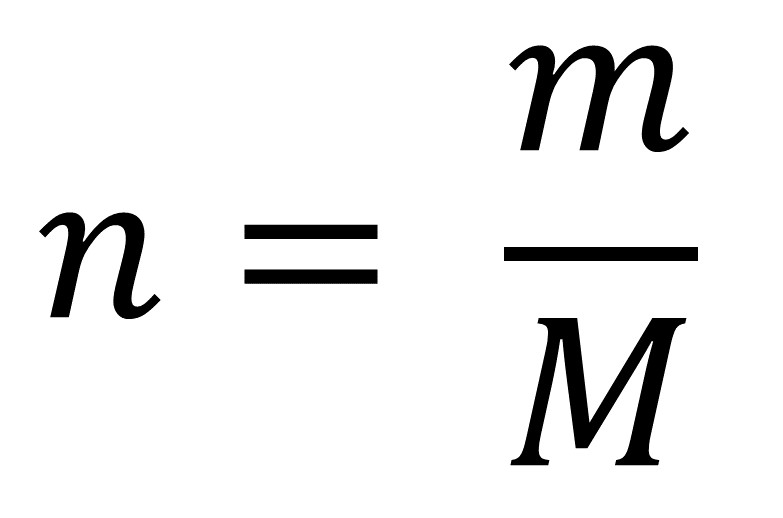







![Wie Berechnet Man Die Stoffmenge Stoffmenge berechnen • Stoffmenge Formel und Rechenbeispiel · [mit Video]](https://d3f6gjnauy613m.cloudfront.net/system/production/videos/004/900/c5f966c940aea2b8f2caaff68d921d43ef0e9c28/Thumbnail_Stoffmenge_berechnen.png?1715775852)
