Wie Ist Ein Enzym Aufgebaut
Eine Reise in die Welt der Enzyme ist eine Reise in das Herz der Biochemie. Diese faszinierenden Moleküle, die biologischen Katalysatoren, sind für das Leben, wie wir es kennen, unerlässlich. Doch wie sind diese komplexen Strukturen aufgebaut, die Reaktionen beschleunigen und Prozesse ermöglichen, die sonst unvorstellbar langsam ablaufen würden? Die Antwort liegt in einer raffinierten Architektur, die auf den Prinzipien der Proteinchemie basiert.
Die Bausteine: Aminosäuren und Peptidbindungen
Jedes Enzym ist im Grunde ein Protein, aufgebaut aus einer Kette von Aminosäuren. Diese Aminosäuren sind durch Peptidbindungen miteinander verbunden, wodurch eine lange, lineare Kette entsteht. Es gibt 20 verschiedene Aminosäuren, die in unterschiedlicher Reihenfolge und Häufigkeit angeordnet sein können, was zu einer unendlichen Vielfalt an möglichen Protein- und somit Enzymstrukturen führt. Jede Aminosäure besteht aus einer Aminogruppe (-NH2), einer Carboxylgruppe (-COOH), einem Wasserstoffatom und einer variablen Seitenkette (R-Gruppe), die sich von Aminosäure zu Aminosäure unterscheidet und ihre spezifischen Eigenschaften bestimmt.
Die Reihenfolge der Aminosäuren in der Polypeptidkette wird als Primärstruktur bezeichnet. Sie ist genetisch codiert und bestimmt letztendlich die dreidimensionale Struktur und somit die Funktion des Enzyms. Die Primärstruktur ist wie eine Buchstabenfolge, die das Wort bildet; eine Änderung dieser Reihenfolge kann die Bedeutung des Wortes (die Funktion des Enzyms) vollständig verändern.
Die Faltung: Sekundär- und Tertiärstruktur
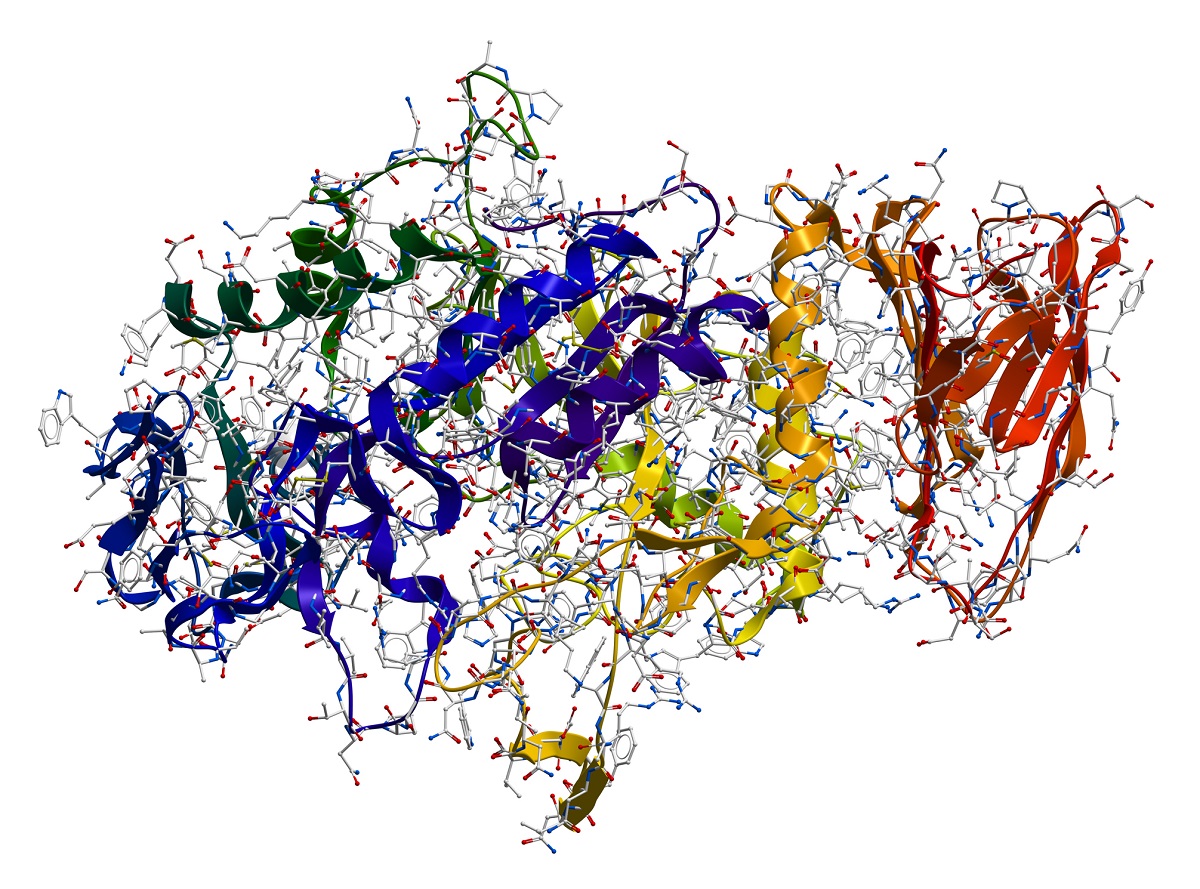
Die Polypeptidkette allein ist jedoch noch kein funktionierendes Enzym. Sie muss sich falten und eine komplexe dreidimensionale Struktur annehmen. Diese Faltung beginnt mit der Bildung von Sekundärstrukturen, die durch Wasserstoffbrückenbindungen zwischen den Aminogruppen und Carboxylgruppen der Peptidbindungen stabilisiert werden. Die häufigsten Sekundärstrukturen sind die α-Helix und das β-Faltblatt. Die α-Helix ist eine spiralförmige Struktur, während das β-Faltblatt aus zwei oder mehreren parallelen oder antiparallelen Polypeptidketten besteht, die nebeneinander liegen und durch Wasserstoffbrücken verbunden sind.
Die Sekundärstrukturen falten sich weiter zu einer Tertiärstruktur, die die vollständige dreidimensionale Form des Enzyms darstellt. Diese Faltung wird durch eine Vielzahl von Kräften angetrieben, darunter Van-der-Waals-Kräfte, hydrophobe Wechselwirkungen, elektrostatische Anziehungen und Disulfidbrücken. Hydrophobe Wechselwirkungen spielen eine besonders wichtige Rolle, da sie dazu führen, dass sich die unpolaren Seitenketten der Aminosäuren im Inneren des Enzyms zusammenlagern, während die polaren Seitenketten an der Oberfläche exponiert sind. Disulfidbrücken, die zwischen zwei Cysteinresten gebildet werden können, tragen zur Stabilisierung der Tertiärstruktur bei.
Die Versammlung: Quartärstruktur
Einige Enzyme bestehen aus mehreren Polypeptidketten, die als Untereinheiten bezeichnet werden. Die räumliche Anordnung und Wechselwirkung dieser Untereinheiten bilden die Quartärstruktur des Enzyms. Diese Struktur kann durch ionische Bindungen, Wasserstoffbrücken und hydrophobe Interaktionen stabilisiert werden. Enzyme mit einer Quartärstruktur können über eine verbesserte Regulation und Kooperativität verfügen. Das bedeutet, dass die Aktivität einer Untereinheit die Aktivität anderer Untereinheiten beeinflussen kann.
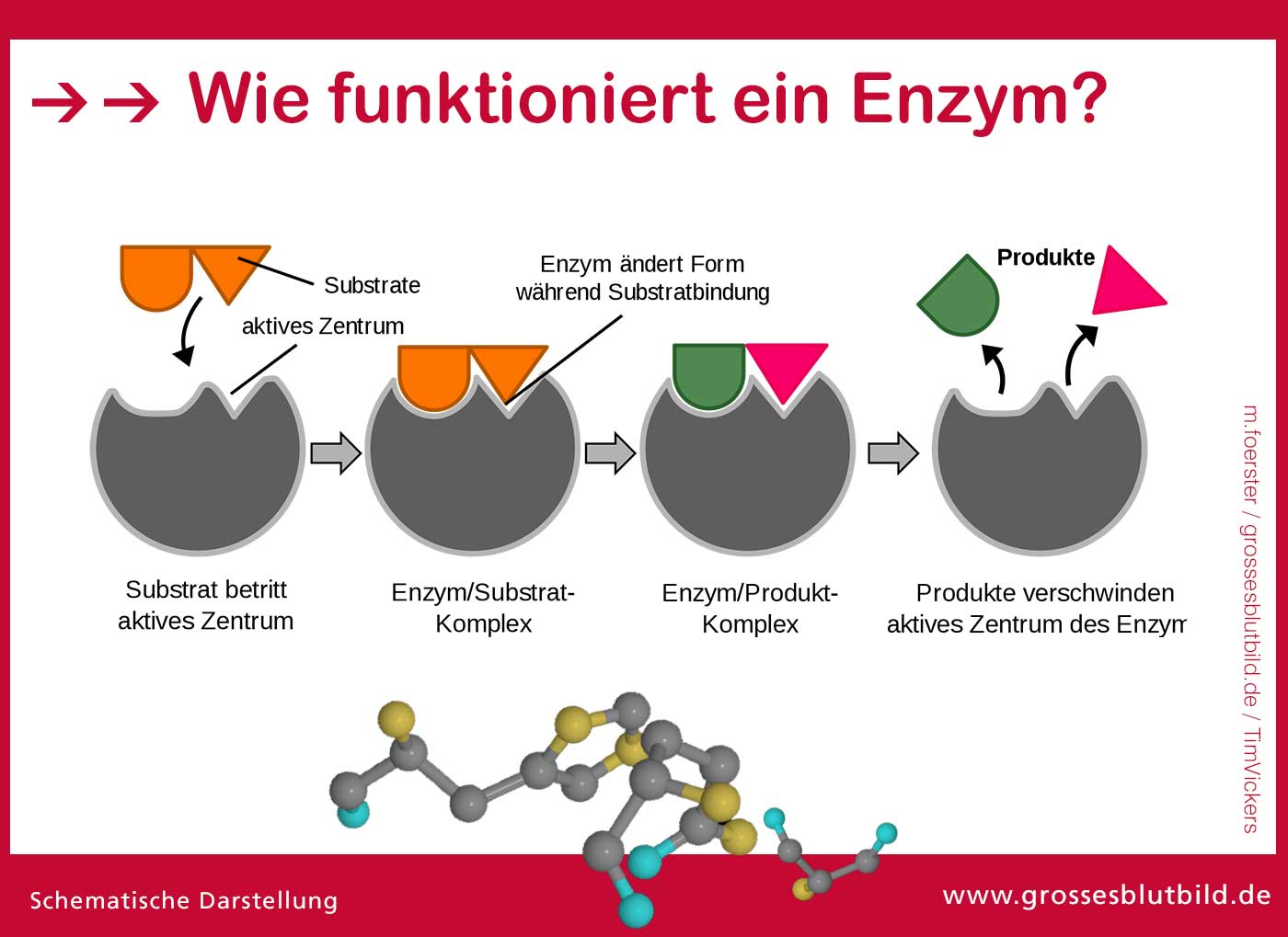
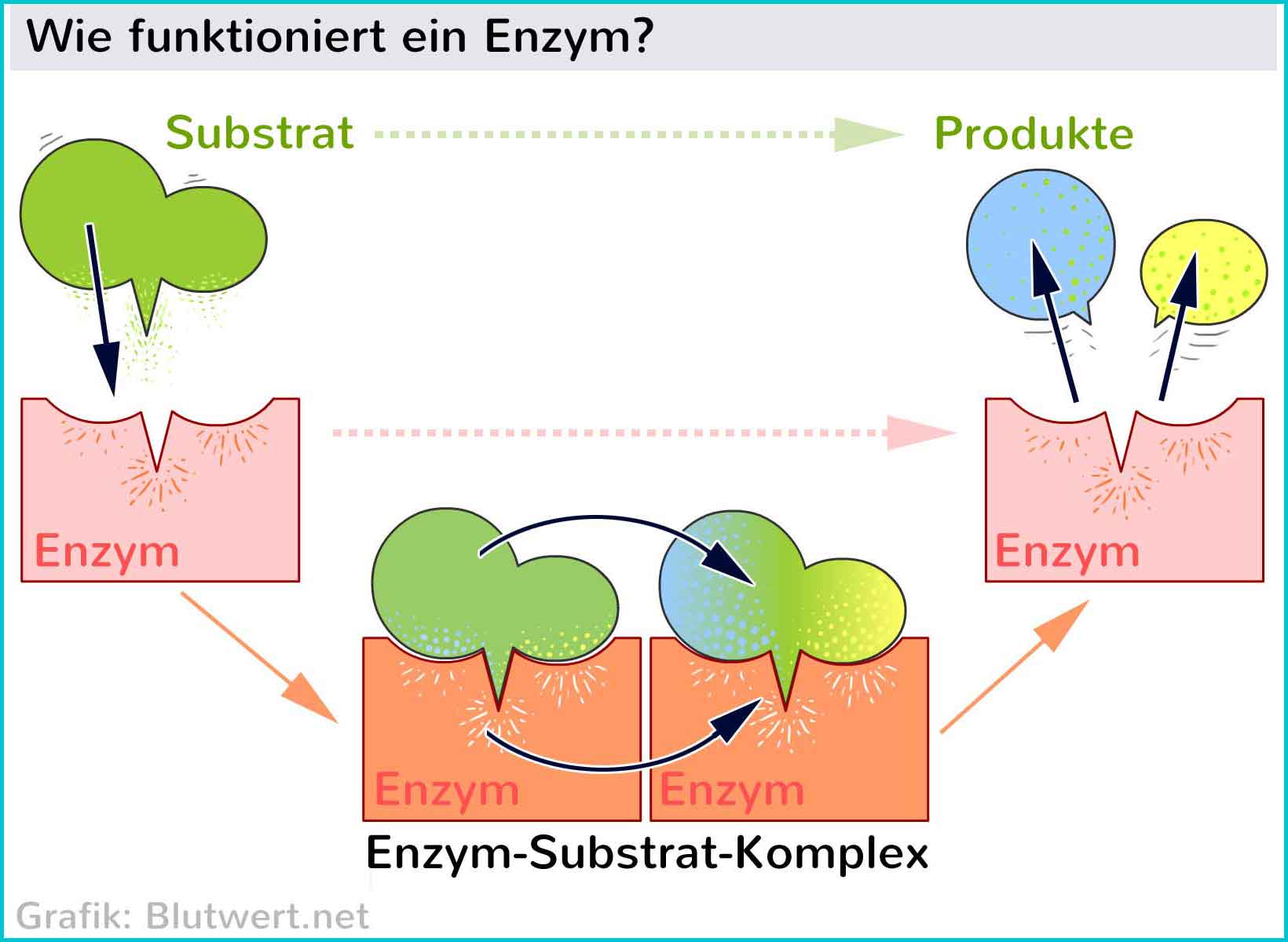
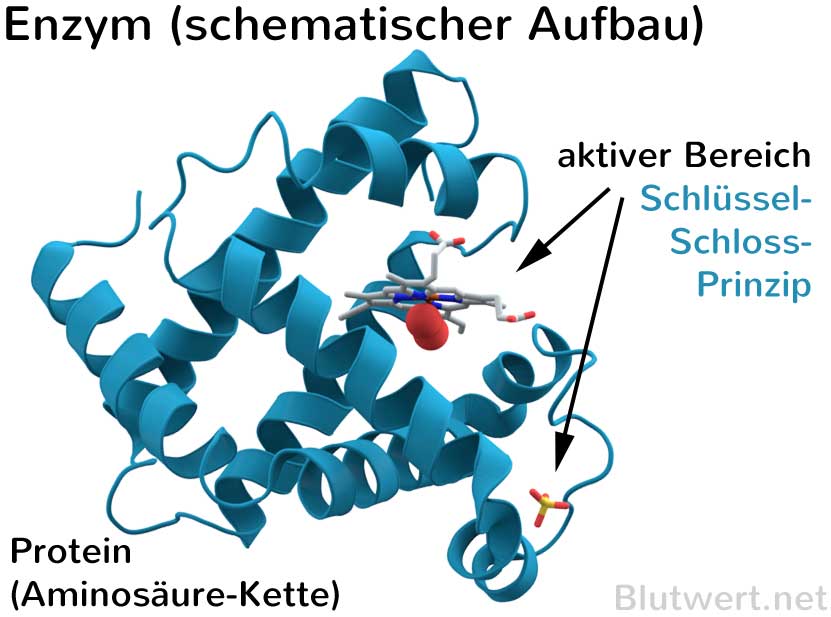
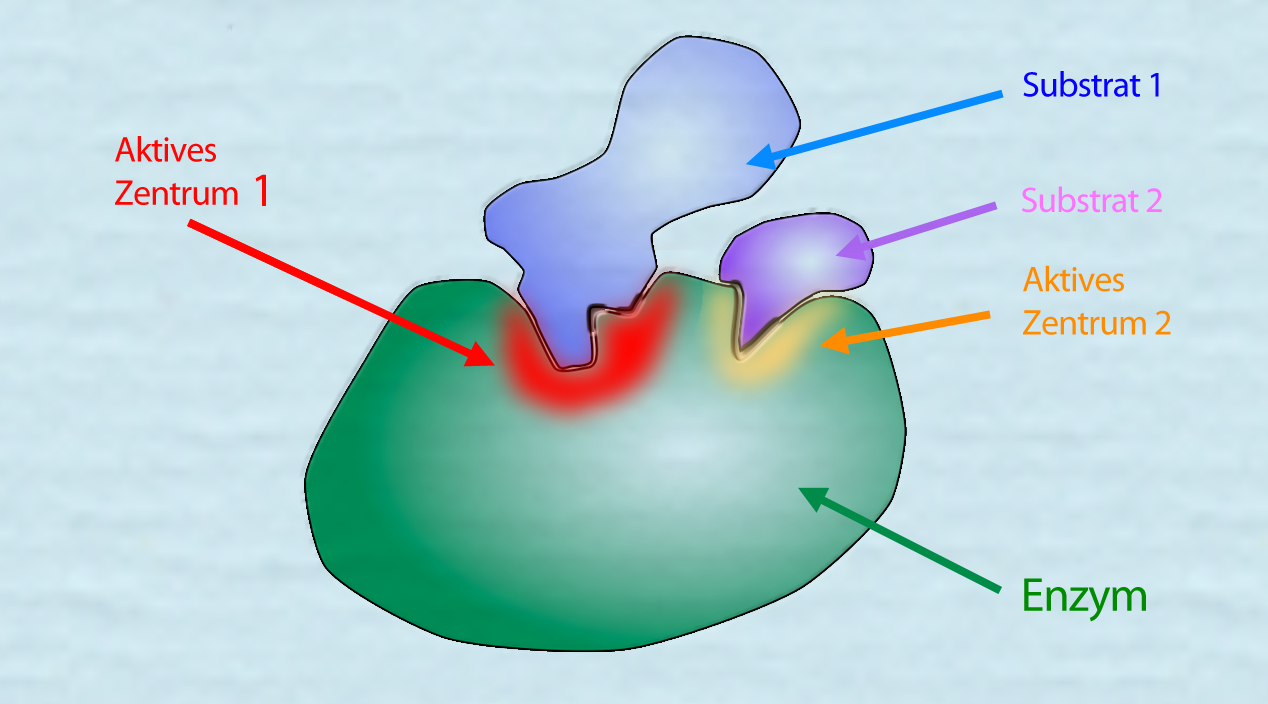
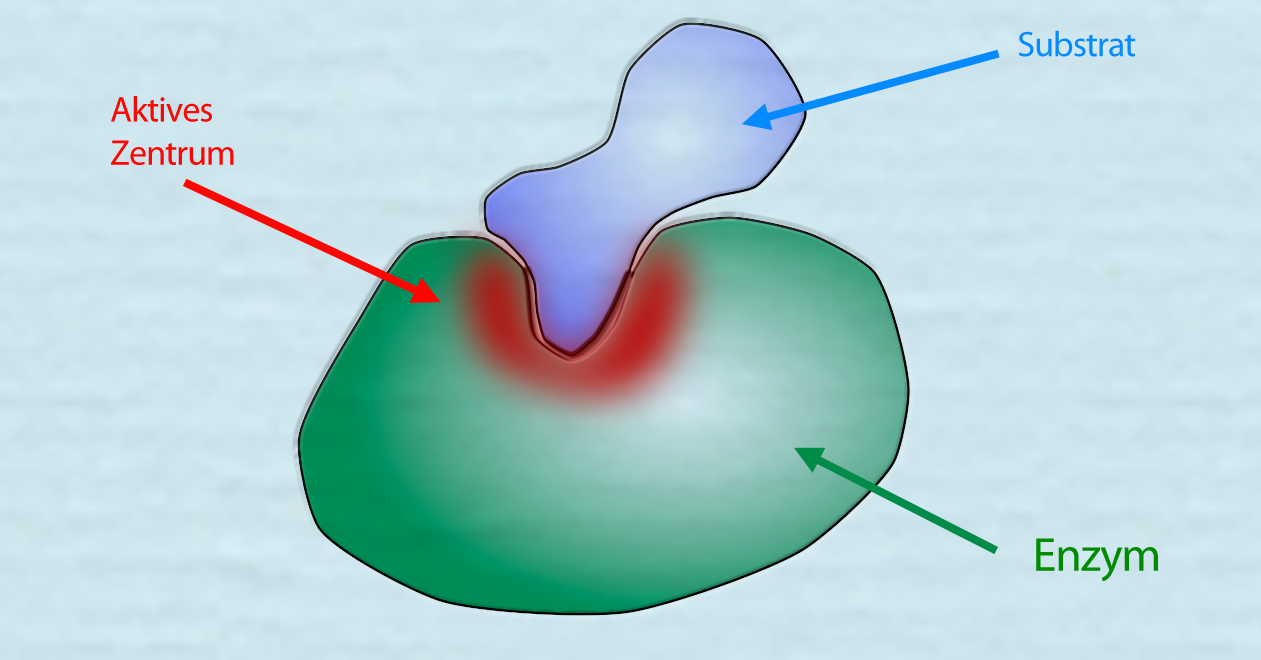
Das Aktive Zentrum: Der Schlüssel zur Katalyse
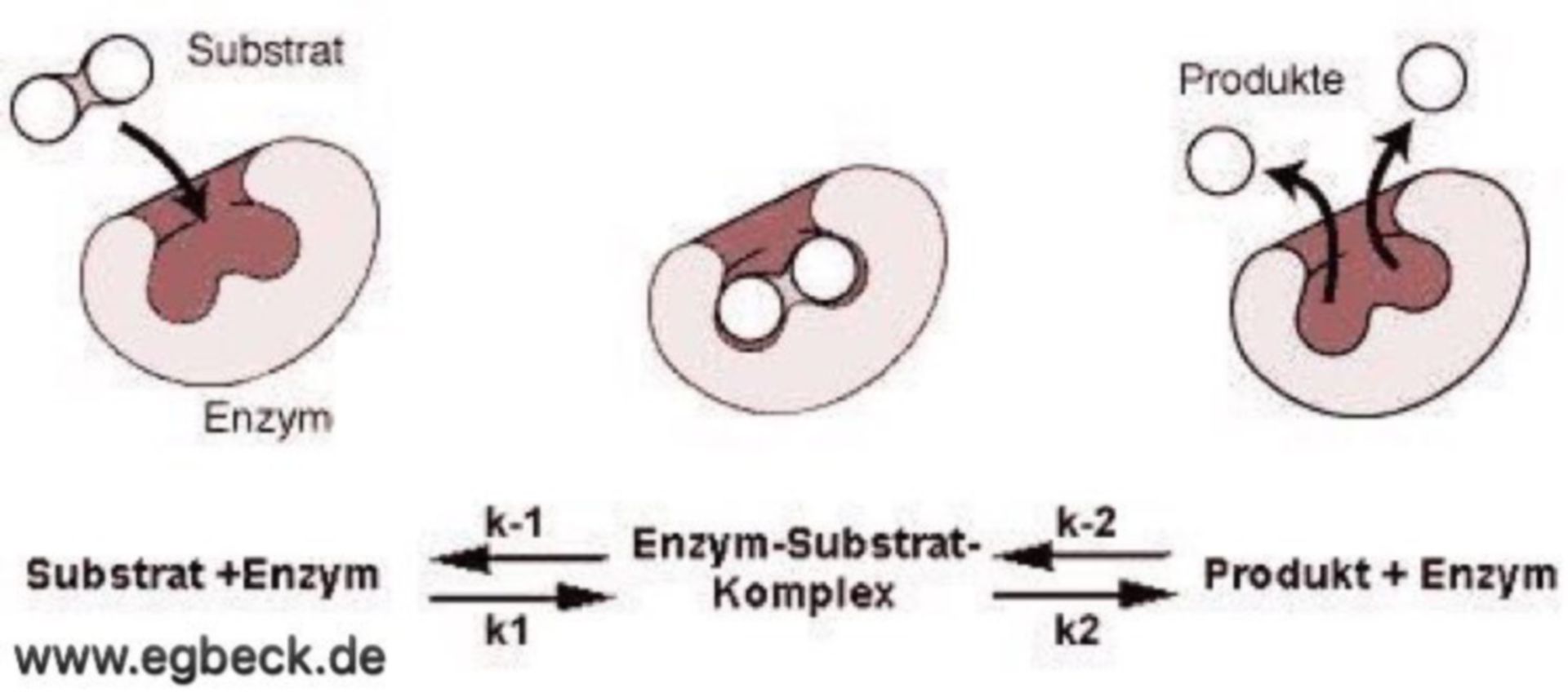
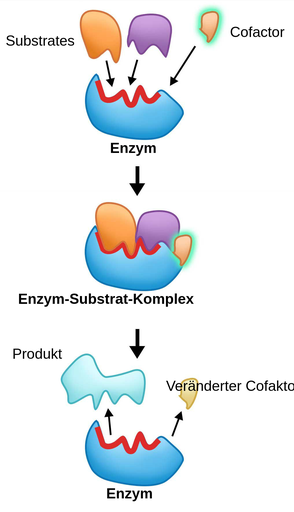
Das Herzstück jedes Enzyms ist das aktive Zentrum, eine spezifische Region, die an die Substrate bindet und die chemische Reaktion katalysiert. Das aktive Zentrum ist in der Regel ein dreidimensionaler Hohlraum oder eine Furche, die durch die Faltung der Polypeptidkette geformt wird. Die Aminosäurereste, die das aktive Zentrum bilden, sind nicht unbedingt in der Aminosäuresequenz benachbart, sondern werden durch die dreidimensionale Faltung zusammengebracht.
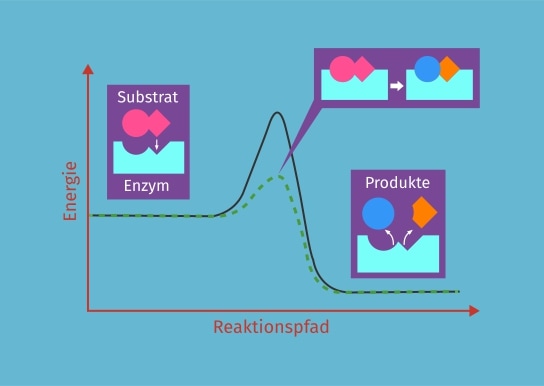
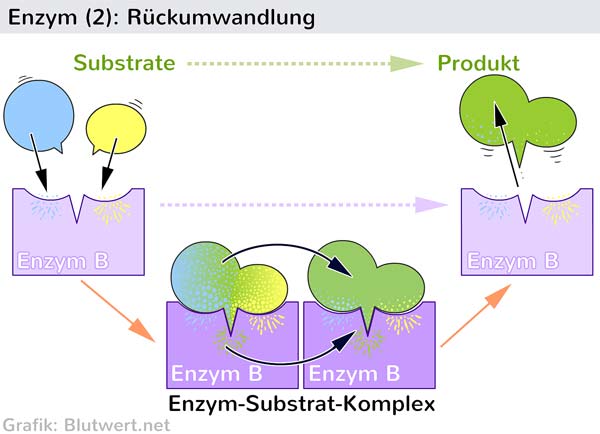
Die Wechselwirkung zwischen dem Enzym und dem Substrat im aktiven Zentrum ist hochspezifisch. Dies wird oft mit dem Schlüssel-Schloss-Prinzip verglichen, bei dem das Substrat wie ein Schlüssel perfekt in das Schloss des aktiven Zentrums passt. Eine präzisere Beschreibung ist jedoch das Induced-Fit-Modell, bei dem sich das aktive Zentrum des Enzyms leicht verändert, um die Bindung an das Substrat zu optimieren. Diese Anpassung ermöglicht eine engere und stabilere Bindung, was die Katalyse der Reaktion fördert.
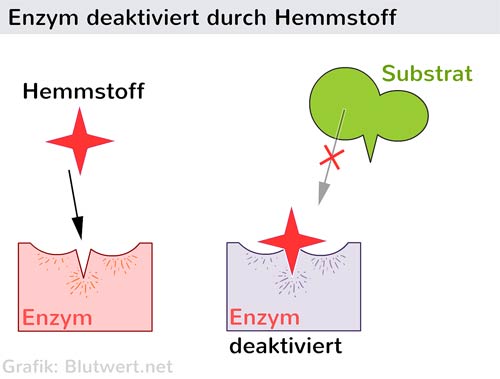
Die Aminosäurereste im aktiven Zentrum spielen eine entscheidende Rolle bei der Katalyse. Sie können als Säuren oder Basen wirken, kovalente Bindungen mit dem Substrat eingehen oder Übergangszustände stabilisieren. Einige Enzyme benötigen auch Cofaktoren, das sind Nicht-Protein-Moleküle, die für die Aktivität des Enzyms unerlässlich sind. Cofaktoren können Metallionen (z.B. Eisen, Zink, Magnesium) oder organische Moleküle (z.B. Vitamine) sein.
Die Bedeutung der Struktur für die Funktion
Der Zusammenhang zwischen der Struktur und der Funktion eines Enzyms ist fundamental. Die dreidimensionale Struktur des Enzyms bestimmt seine Fähigkeit, an spezifische Substrate zu binden, die Reaktion zu katalysieren und durch verschiedene Faktoren reguliert zu werden. Veränderungen der Struktur, beispielsweise durch Mutationen, Temperaturerhöhungen oder pH-Wert-Änderungen, können die Funktion des Enzyms beeinträchtigen oder sogar vollständig zerstören. Diese Denaturierung des Enzyms führt zum Verlust seiner katalytischen Aktivität.
Das Verständnis des Aufbaus von Enzymen ist von entscheidender Bedeutung für viele Bereiche der Wissenschaft und Technologie. In der Medizin ermöglicht es die Entwicklung von Medikamenten, die spezifisch an Enzyme binden und ihre Aktivität hemmen können, um Krankheiten zu behandeln. In der Biotechnologie werden Enzyme eingesetzt, um chemische Reaktionen zu katalysieren und Produkte herzustellen. Und in der Grundlagenforschung hilft das Studium von Enzymen, die grundlegenden Prinzipien des Lebens zu verstehen.
Indem wir die komplizierten Details der Enzymstruktur entschlüsseln, erhalten wir einen tieferen Einblick in die faszinierende Welt der Biochemie und die komplexen Prozesse, die das Leben ermöglichen. Die Präzision und Effizienz dieser molekularen Maschinen sind ein Beweis für die Eleganz und die Kraft der Evolution.
![Wie Ist Ein Enzym Aufgebaut Enzyme • Definition, Aufbau und Funktion · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/02/01_Enzymreaktion-1-1024x576.jpg)
![Wie Ist Ein Enzym Aufgebaut Enzyme • Definition, Aufbau und Funktion · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/02/02_Schematischer-Aufbau-eines-Enzyms-1024x576.jpg)

![Wie Ist Ein Enzym Aufgebaut Enzyme • Definition, Aufbau und Funktion · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/02/06_Schlüssel-Schloss-Prinzip-bei-Enzymen-1024x576.jpg)