Wie Viele Bindungen Kann Sauerstoff Eingehen

Sauerstoff ist ein allgegenwärtiges Element, das für das Leben, wie wir es kennen, unerlässlich ist. Es bildet einen wichtigen Bestandteil der Luft, die wir atmen, und ist an unzähligen chemischen Reaktionen beteiligt. Eine Schlüsselfrage beim Verständnis des Verhaltens von Sauerstoff ist die Frage nach seiner Bindungsfähigkeit: Wie viele Bindungen kann ein Sauerstoffatom eingehen?
Die Grundlagen der chemischen Bindung
Um diese Frage zu beantworten, müssen wir zunächst die Grundlagen der chemischen Bindung verstehen. Atome bilden Bindungen, um einen stabileren Zustand zu erreichen, typischerweise indem sie ihre äußere Elektronenschale (Valenzschale) mit Elektronen füllen. Diese Tendenz wird oft durch die Oktettregel vereinfacht, die besagt, dass Atome dazu neigen, Bindungen einzugehen, um acht Elektronen in ihrer Valenzschale zu erhalten. Es gibt jedoch Ausnahmen von dieser Regel, insbesondere für leichtere Elemente wie Wasserstoff und auch für Elemente der dritten Periode und darunter.
Es gibt verschiedene Arten von chemischen Bindungen, darunter:
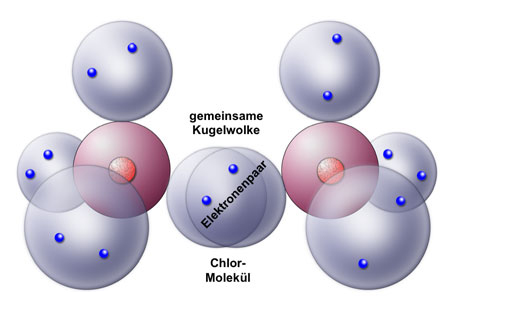
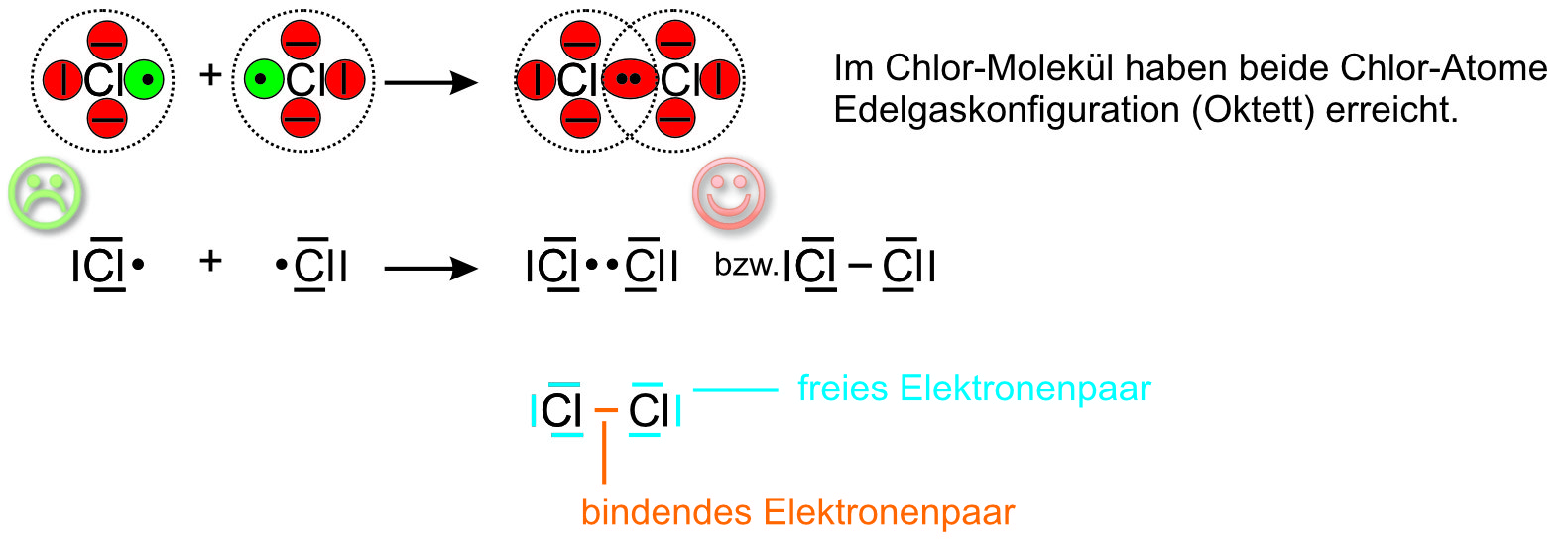
- Kovalente Bindungen: Diese entstehen, wenn Atome Elektronen miteinander teilen. Kovalente Bindungen sind typischerweise zwischen Nichtmetallen zu finden.
- Ionenbindungen: Diese entstehen durch die Übertragung von Elektronen von einem Atom auf ein anderes, wodurch positiv geladene Ionen (Kationen) und negativ geladene Ionen (Anionen) entstehen. Die elektrostatische Anziehung zwischen diesen Ionen hält die Bindung zusammen. Ionenbindungen entstehen typischerweise zwischen Metallen und Nichtmetallen.
- Metallische Bindungen: Diese treten in Metallen auf, wo Valenzelektronen delokalisiert sind und ein "Elektronengas" bilden, das die Metallionen zusammenhält.
Sauerstoff bildet hauptsächlich kovalente Bindungen.
Die Elektronenkonfiguration von Sauerstoff
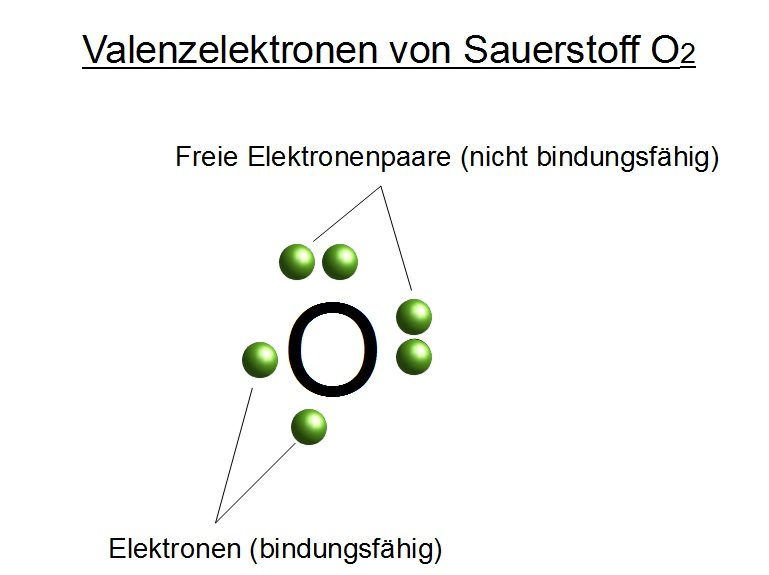
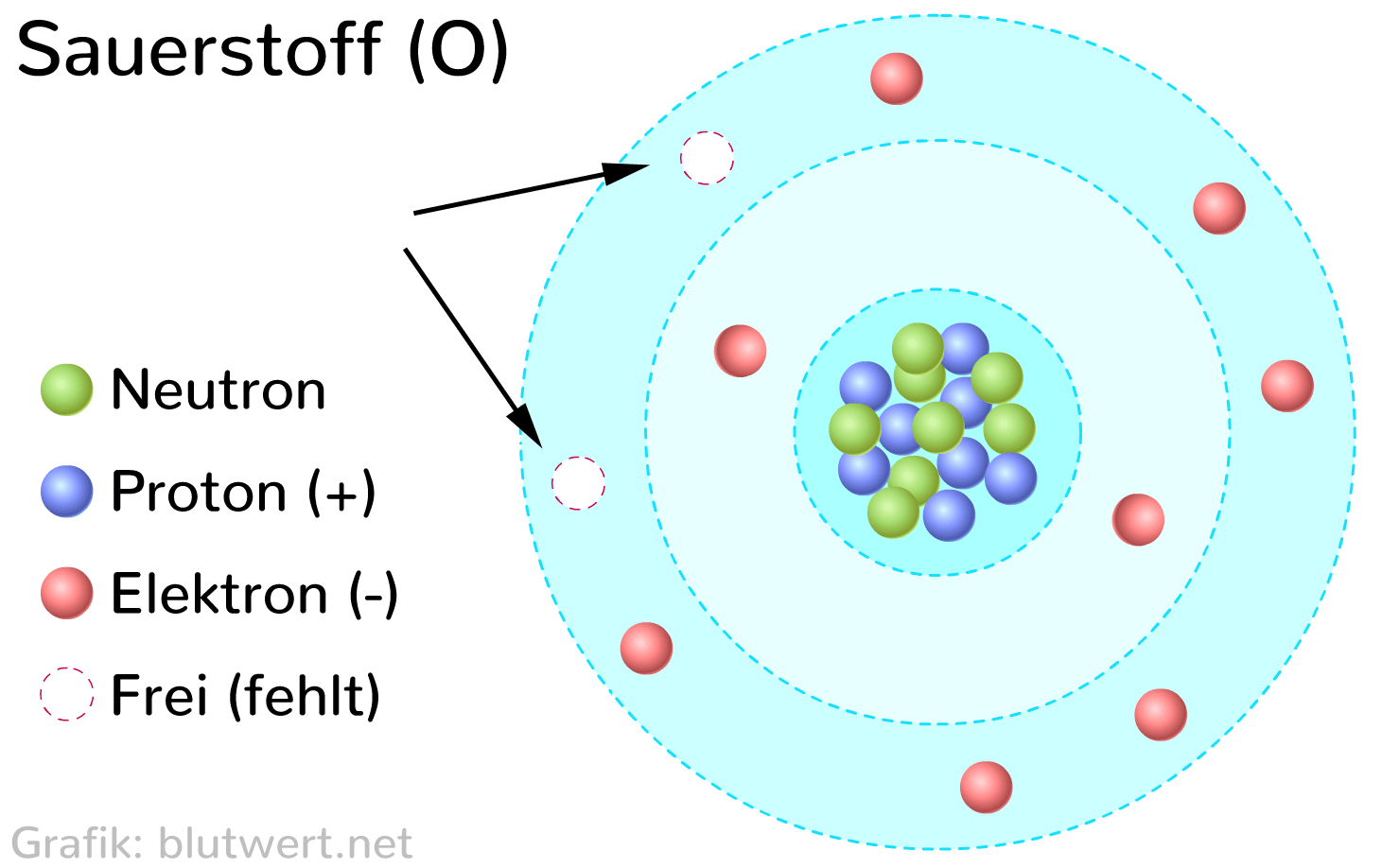
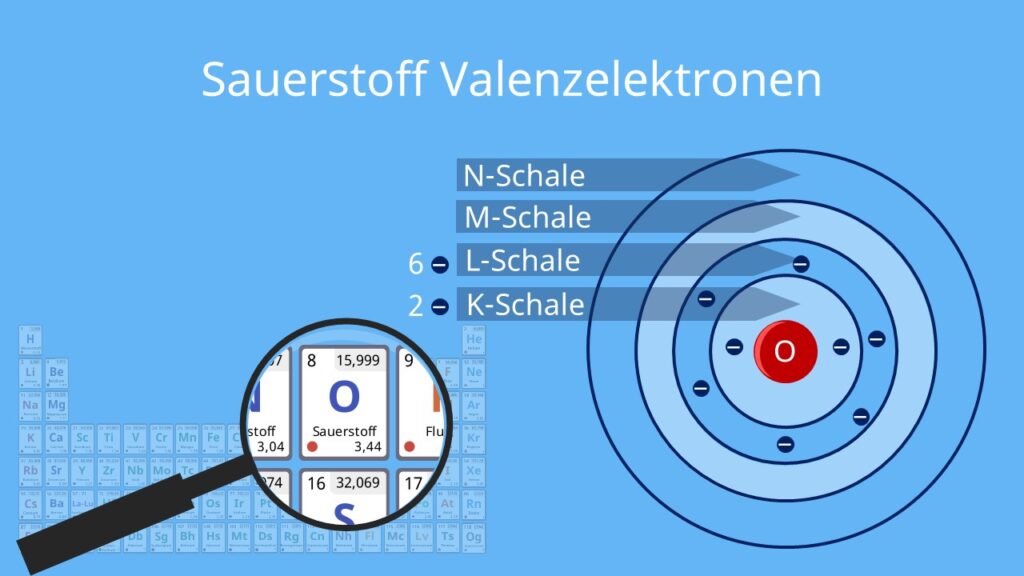
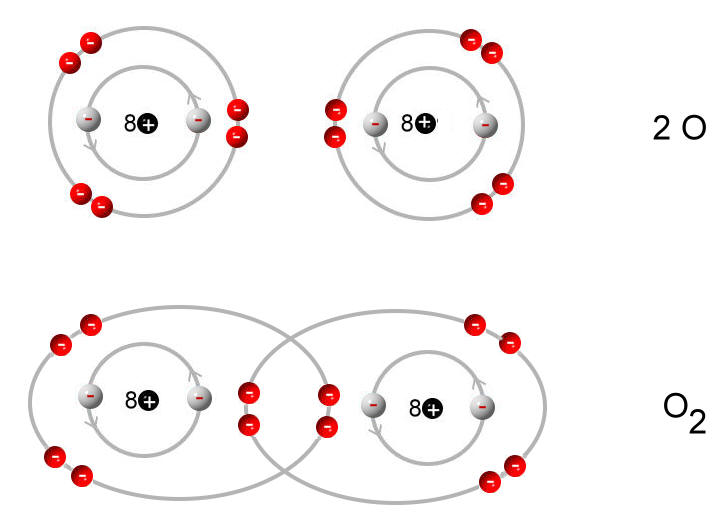
Die Elektronenkonfiguration von Sauerstoff (O) ist 1s2 2s2 2p4. Das bedeutet, dass Sauerstoff sechs Valenzelektronen in seiner äußeren Schale hat (2s2 2p4). Um die Oktettregel zu erfüllen und eine stabile Elektronenkonfiguration zu erreichen, benötigt Sauerstoff zwei weitere Elektronen.
Aus diesem Grund bildet Sauerstoff typischerweise zwei kovalente Bindungen. Diese Bindungen können entweder zwei einzelne Bindungen oder eine Doppelbindung sein.
Beispiele für Sauerstoffbindungen
Hier sind einige Beispiele, die veranschaulichen, wie Sauerstoff zwei Bindungen eingehen kann:
- Wasser (H2O): In einem Wassermolekül ist jedes Sauerstoffatom mit zwei Wasserstoffatomen verbunden. Jede Bindung ist eine einzelne kovalente Bindung, wobei Sauerstoff ein Elektron mit jedem Wasserstoffatom teilt. Die Formel H-O-H verdeutlicht die Struktur.
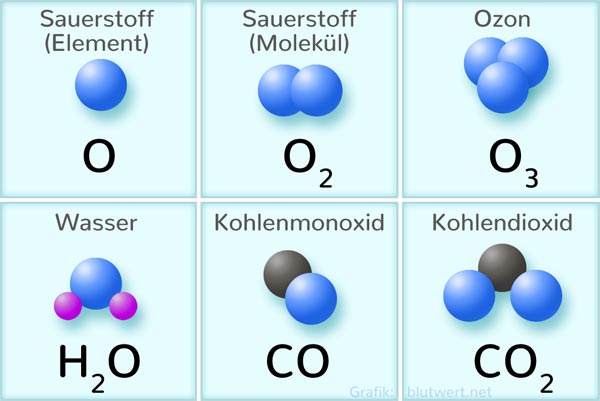
- Kohlendioxid (CO2): In Kohlendioxid ist das Sauerstoffatom über eine Doppelbindung mit dem Kohlenstoffatom verbunden. Das bedeutet, dass Sauerstoff zwei Elektronen mit jedem Kohlenstoffatom teilt. Die Struktur ist O=C=O.
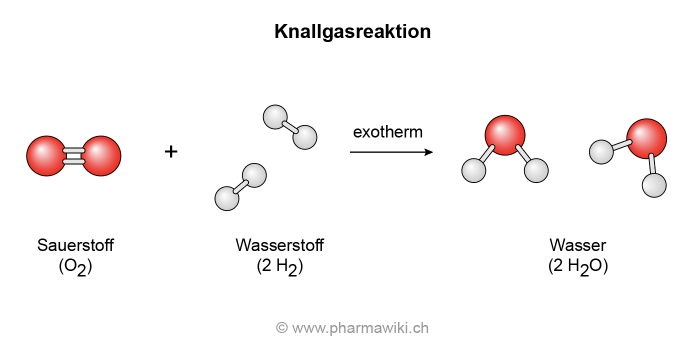
- Sauerstoffgas (O2): Sauerstoffgas besteht aus zwei Sauerstoffatomen, die durch eine Doppelbindung miteinander verbunden sind (O=O). Die Bindung ist stark und erfordert viel Energie, um sie aufzubrechen.
Ausnahmen und Sonderfälle
Obwohl Sauerstoff typischerweise zwei Bindungen eingeht, gibt es Ausnahmen und Sonderfälle:
- Ozon (O3): Ozon ist eine allotrope Form von Sauerstoff, die aus drei Sauerstoffatomen besteht. In diesem Molekül ist ein Sauerstoffatom an zwei andere gebunden, während die anderen beiden Sauerstoffatome jeweils nur an eines gebunden sind. Die Struktur ist etwas komplizierter und beinhaltet resonanzstabilisierte Strukturen. Formal trägt das zentrale Sauerstoffatom eine positive Formalladung und eines der äußeren Sauerstoffatome eine negative Formalladung.
- Superoxide (O2-): Superoxide sind Ionen, die ein einzelnes ungepaartes Elektron und eine negative Ladung tragen. In diesen Fällen bildet Sauerstoff effektiv eine Bindung, aber die Bindungsordnung ist geringer als 2 (typischerweise 1,5). Sie sind sehr reaktiv.
- Peroxide (O22-): Peroxide enthalten die O-O-Bindung, wobei jedes Sauerstoffatom an ein weiteres Atom gebunden ist (normalerweise Wasserstoff in Wasserstoffperoxid, H2O2). Die Bindungsordnung zwischen den Sauerstoffatomen ist in diesem Fall 1.
- Oxoniumionen (H3O+): Das Oxoniumion ist protoniertes Wasser. In diesem Fall bildet Sauerstoff drei Bindungen, wobei eines der Wasserstoffatome als H+-Ion an das Sauerstoffatom gebunden ist. Das Sauerstoffatom trägt hierbei eine positive Formalladung.
Diese Ausnahmen sind wichtig, um die Vielfalt der Sauerstoffchemie zu verstehen. Sie treten typischerweise unter speziellen Bedingungen auf oder sind Teil von komplexeren Molekülen.
Die Bedeutung der Zweiwertigkeit von Sauerstoff
Die Tatsache, dass Sauerstoff typischerweise zwei Bindungen eingeht, hat tiefgreifende Auswirkungen auf die Struktur und Eigenschaften von Molekülen, die Sauerstoff enthalten. Zum Beispiel ist die gewinkelte Form des Wassermoleküls (H2O) direkt auf die zwei Bindungen des Sauerstoffs und die beiden nicht-bindenden Elektronenpaare auf dem Sauerstoffatom zurückzuführen. Diese gewinkelte Form führt zu der Polarität des Wassermoleküls, was wiederum für viele der einzigartigen Eigenschaften des Wassers verantwortlich ist, wie z.B. seine hohe Oberflächenspannung und seine Fähigkeit, viele Stoffe zu lösen.
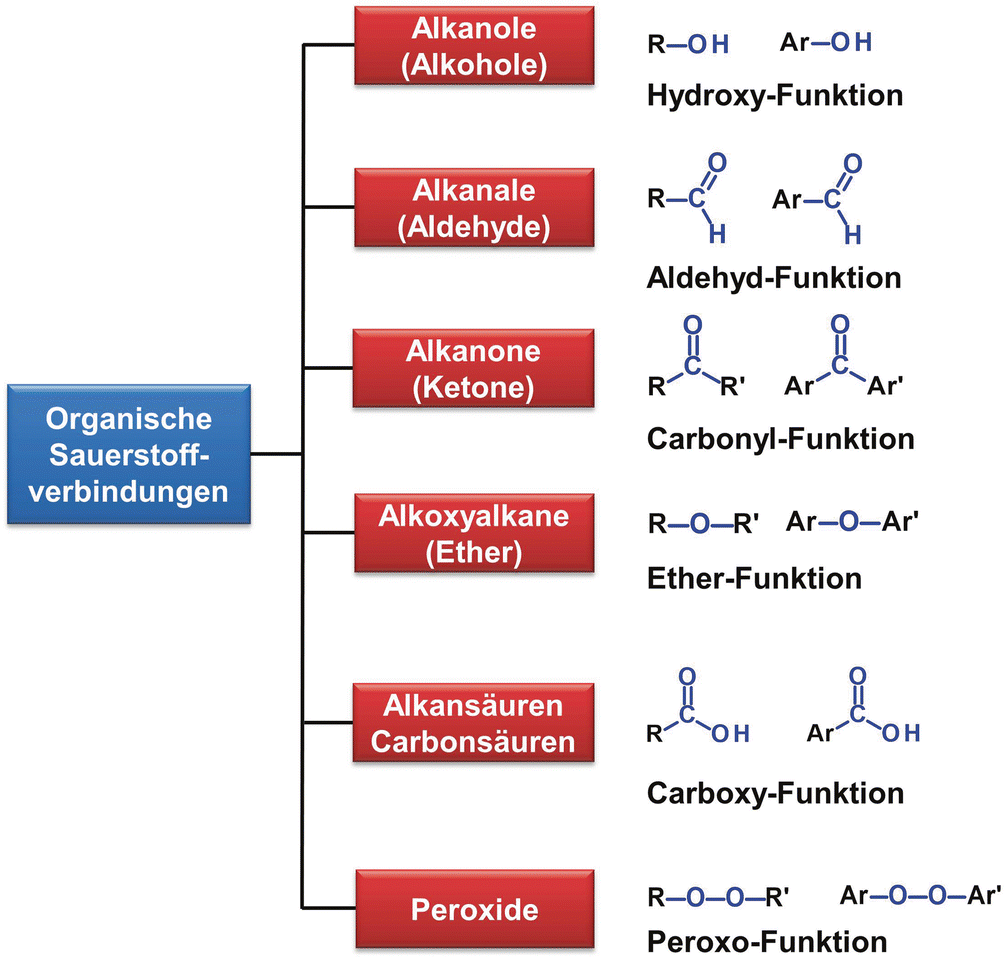
In der organischen Chemie spielt Sauerstoff eine entscheidende Rolle in vielen funktionellen Gruppen, wie z.B. Alkoholen (R-OH), Ethern (R-O-R'), Ketonen (R-C(=O)-R') und Aldehyden (R-C(=O)-H). Die zwei Bindungen des Sauerstoffs ermöglichen es ihm, eine Verbindung zwischen Kohlenstoffatomen und anderen Atomen herzustellen und so die Struktur und Reaktivität dieser funktionellen Gruppen zu beeinflussen. Beispielsweise ist die Reaktivität von Carbonylverbindungen (Ketone und Aldehyde) stark von der Polarität der C=O Doppelbindung beeinflusst.
Zusammenfassend
Sauerstoff kann im Allgemeinen zwei chemische Bindungen eingehen, um ein stabiles Oktett in seiner Valenzschale zu erreichen. Diese Bindungen können zwei einzelne Bindungen oder eine Doppelbindung sein. Obwohl es Ausnahmen von dieser Regel gibt, wie z.B. in Ozon, Superoxiden und Oxoniumionen, ist die Zweiwertigkeit von Sauerstoff ein grundlegendes Konzept, das das Verhalten dieses lebenswichtigen Elements in der Chemie bestimmt.
Das Verständnis der Bindungsfähigkeit von Sauerstoff ist entscheidend für das Verständnis einer Vielzahl chemischer Phänomene, von der Struktur von Wassermolekülen bis hin zur Reaktivität organischer Verbindungen. Indem wir die Grundlagen der chemischen Bindung und die Elektronenkonfiguration von Sauerstoff verstehen, können wir die Rolle dieses Elements in der Welt um uns herum besser würdigen.
Für weitere Informationen zu diesem Thema können Sie Fachbücher der Chemie konsultieren oder online wissenschaftliche Artikel recherchieren. Das Verständnis von Konzepten wie Elektronegativität und Orbitaltheorie kann ebenfalls hilfreich sein, um das Verhalten von Sauerstoff in chemischen Bindungen besser zu verstehen.
Wir hoffen, dass dieser Artikel Ihnen ein klares und prägnantes Verständnis der Bindungsfähigkeit von Sauerstoff vermittelt hat.






![Wie Viele Bindungen Kann Sauerstoff Eingehen Sauerstoff • einfach erklärt: Steckbrief, Nachweis · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/04/Orbitalmodell-Sauerstoff-1-1024x576.jpg)