Wie Viele Elektronen Hat Natrium
Natrium, mit dem chemischen Symbol Na und der Ordnungszahl 11, ist ein allgegenwärtiges Element, das in vielen Bereichen unseres Lebens eine wichtige Rolle spielt. Um seine chemischen Eigenschaften und Reaktionen zu verstehen, ist es entscheidend zu wissen, wie viele Elektronen ein Natriumatom besitzt.
Die Anzahl der Elektronen im Natriumatom
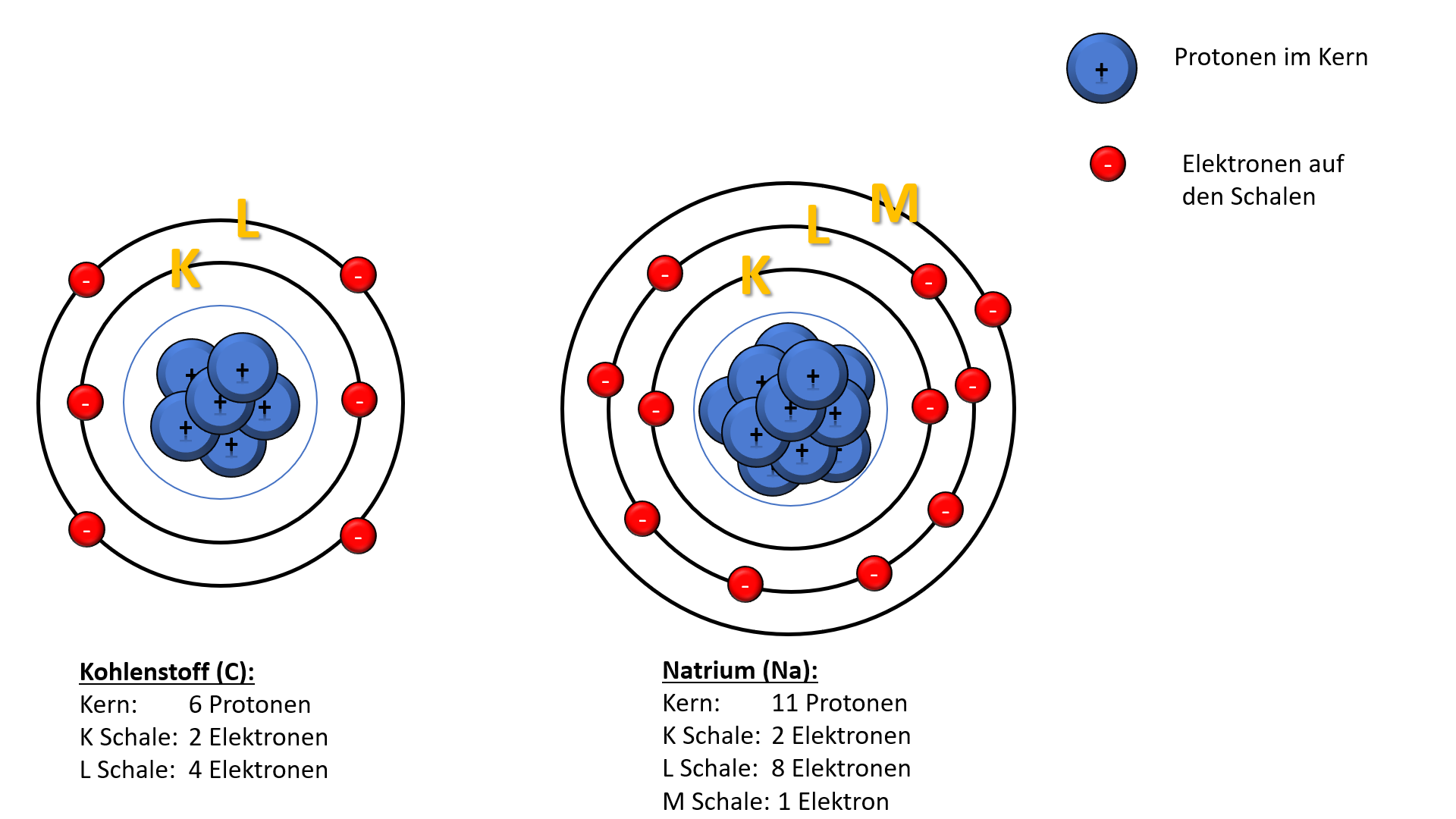
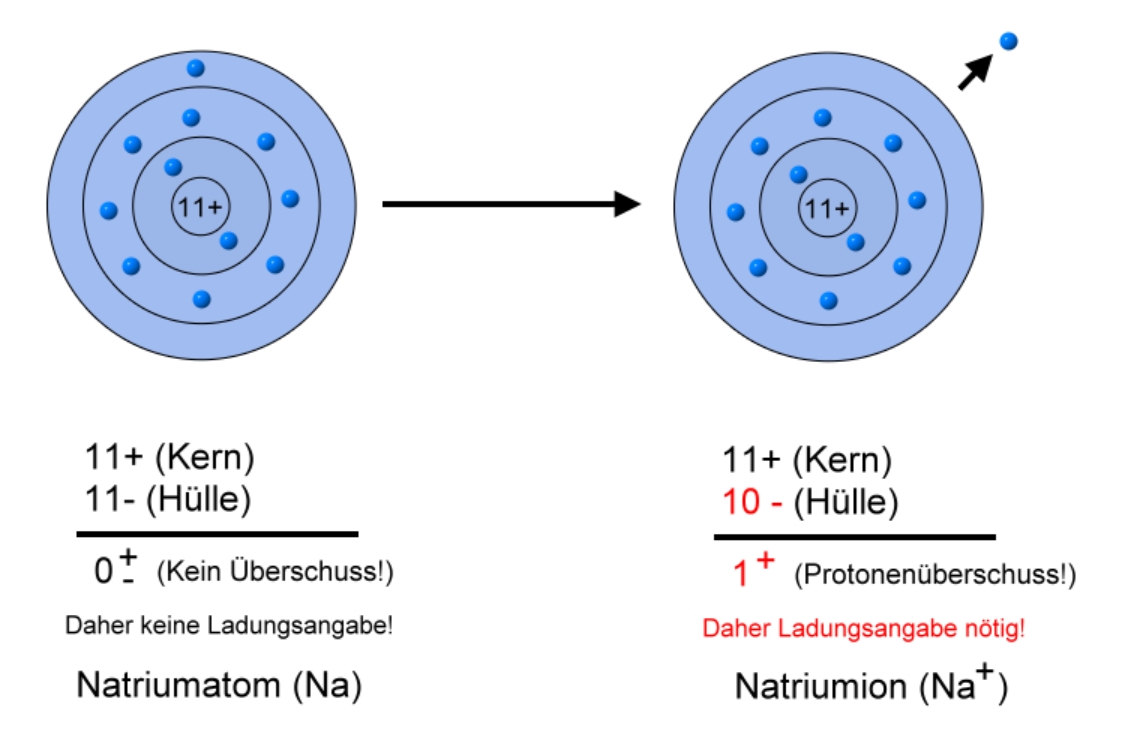
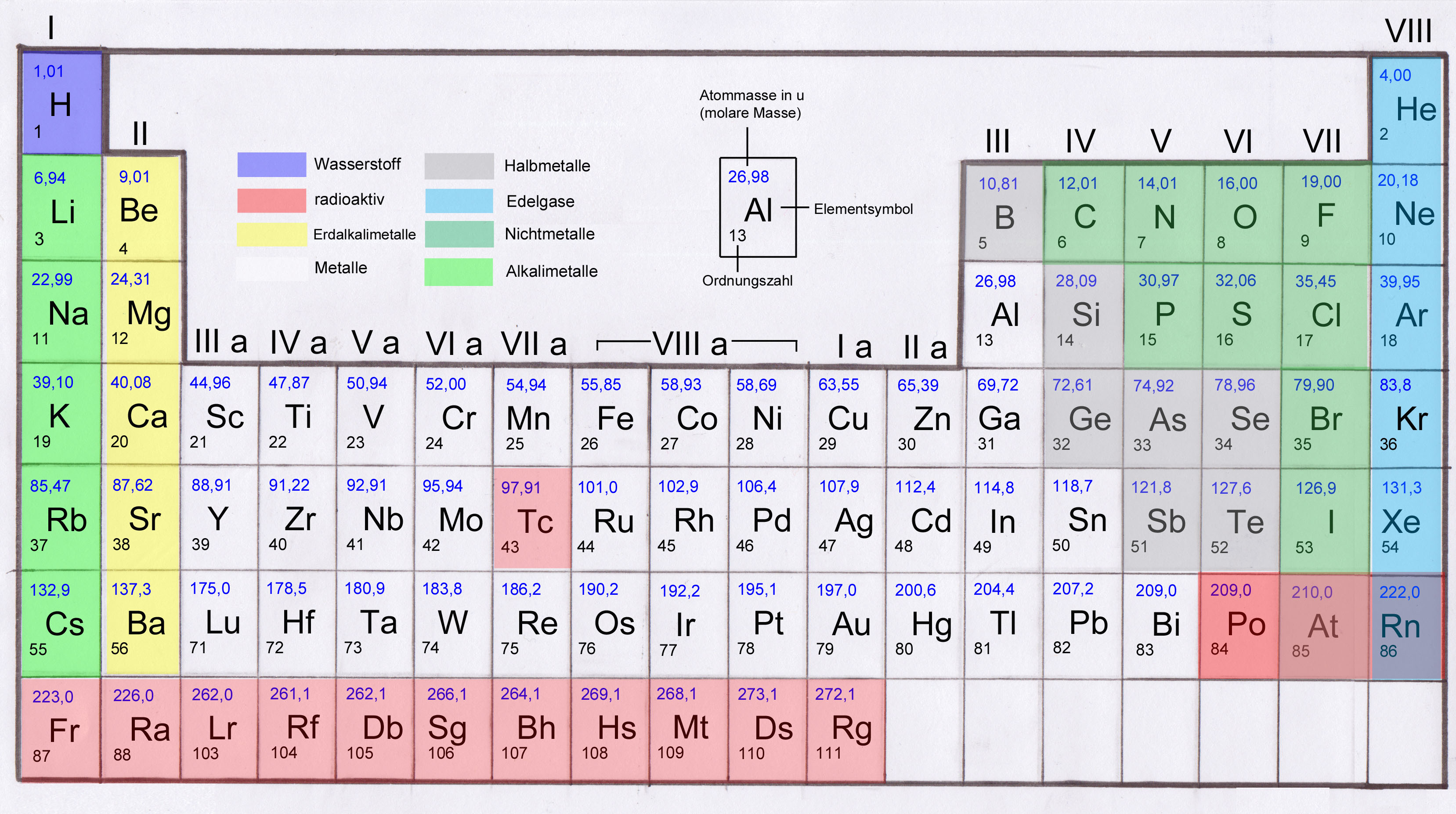
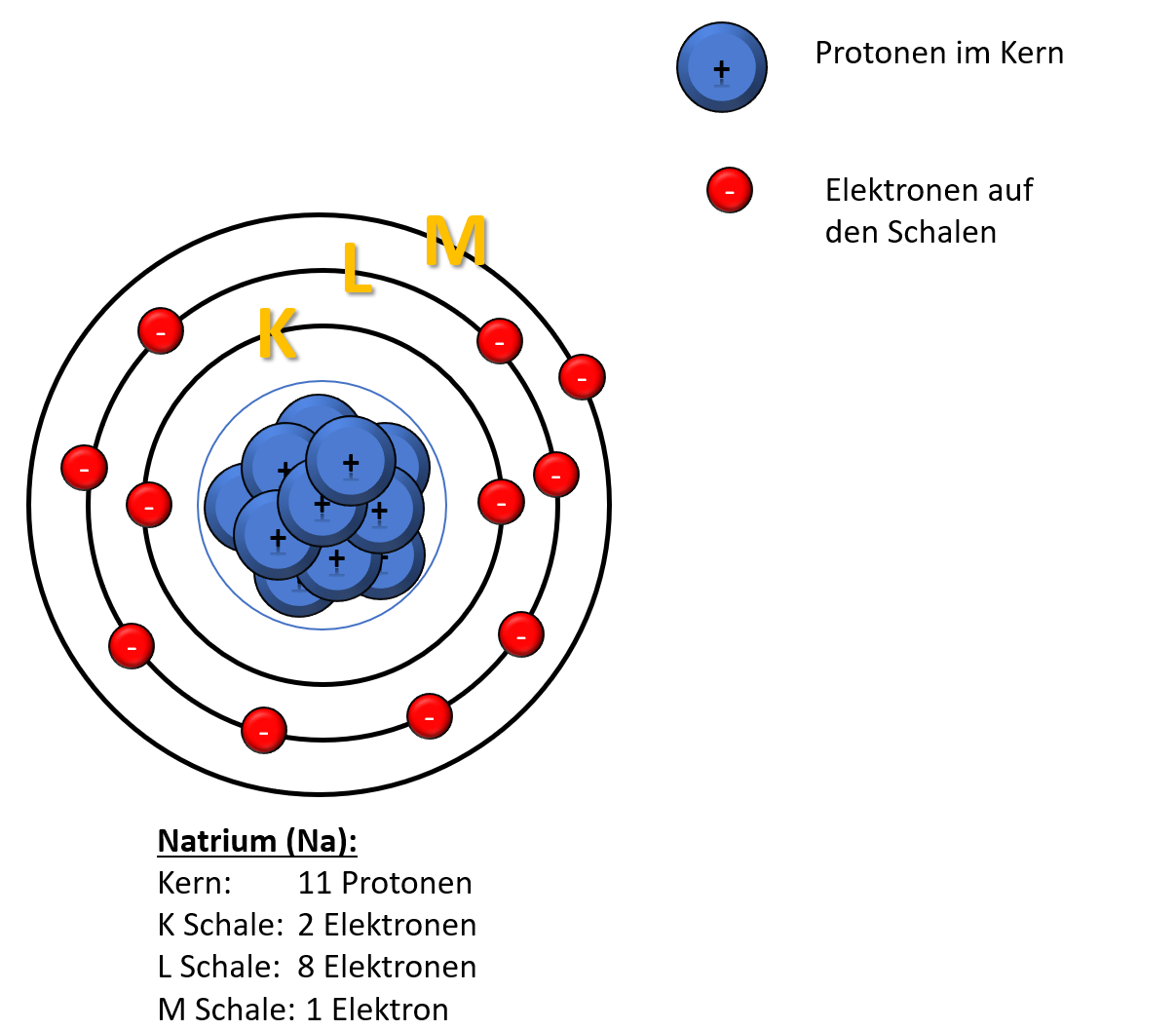
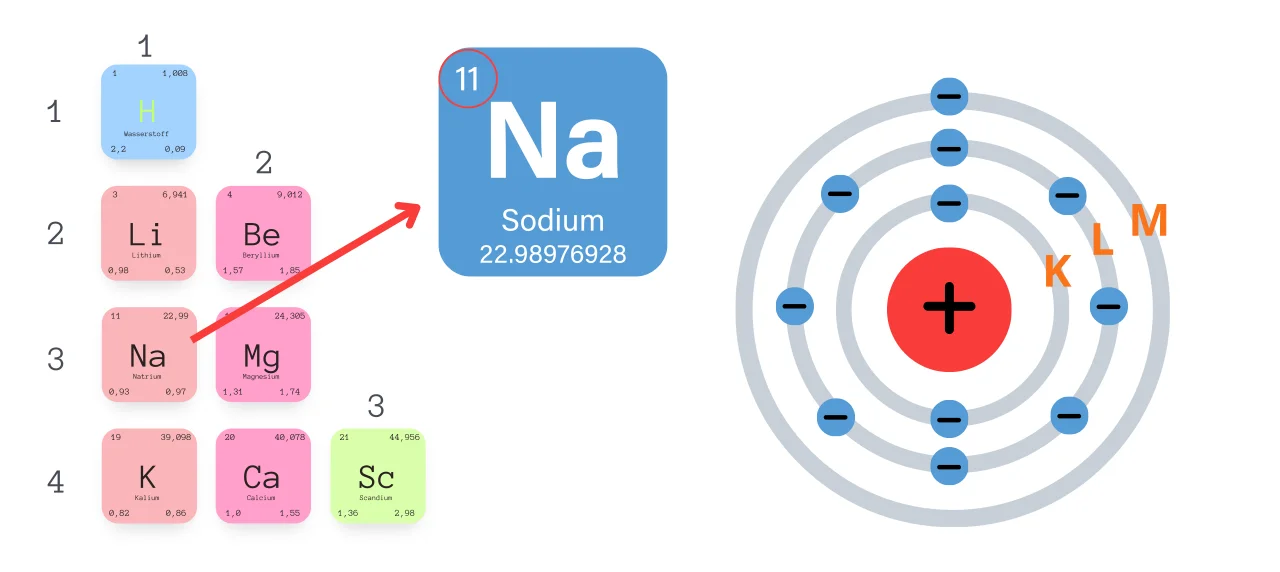
Ein neutrales Natriumatom besitzt 11 Elektronen. Diese Zahl entspricht seiner Ordnungszahl im Periodensystem. Die Ordnungszahl gibt die Anzahl der Protonen im Atomkern eines Elements an, und in einem neutralen Atom ist die Anzahl der Protonen immer gleich der Anzahl der Elektronen. Dies stellt sicher, dass das Atom insgesamt keine elektrische Ladung trägt.
Elektronenkonfiguration von Natrium
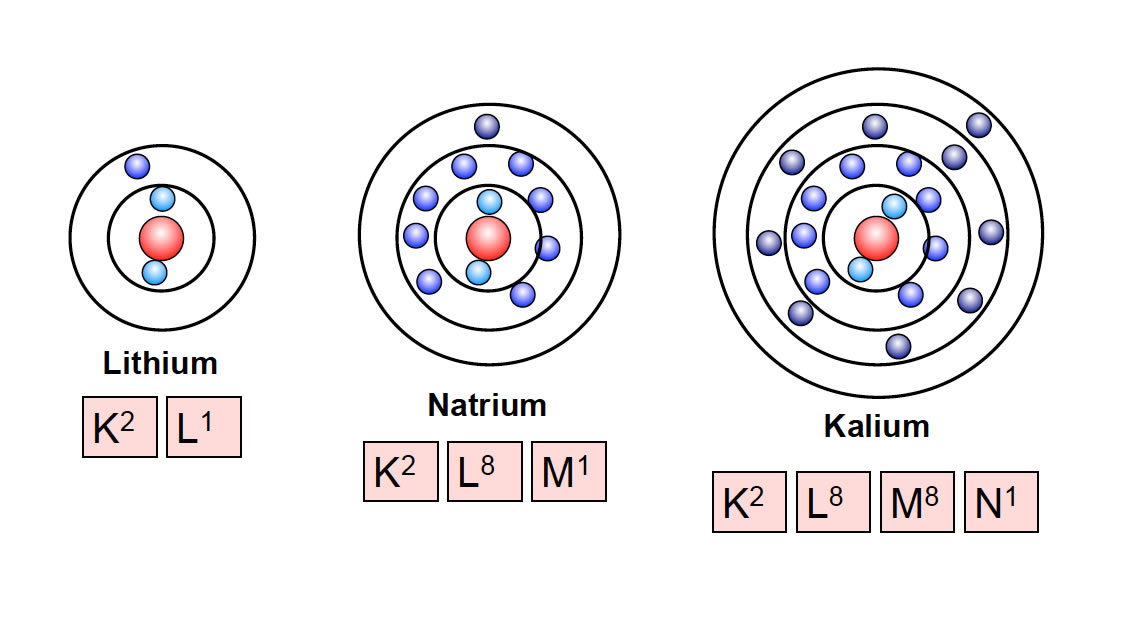
Die 11 Elektronen im Natriumatom sind nicht einfach wahllos um den Atomkern verteilt. Sie sind in verschiedenen Energieniveaus oder Schalen angeordnet. Diese Anordnung wird als Elektronenkonfiguration bezeichnet. Für Natrium lautet die Elektronenkonfiguration: 1s2 2s2 2p6 3s1.
Was bedeutet diese Schreibweise genau?
- 1s2: Die erste Schale (n=1) enthält das s-Orbital, welches mit 2 Elektronen besetzt ist.
- 2s2 2p6: Die zweite Schale (n=2) enthält sowohl das s-Orbital (2 Elektronen) als auch drei p-Orbitale (insgesamt 6 Elektronen). Somit sind in der zweiten Schale insgesamt 8 Elektronen vorhanden.
- 3s1: Die dritte Schale (n=3) enthält nur ein s-Orbital, das mit einem Elektron besetzt ist.
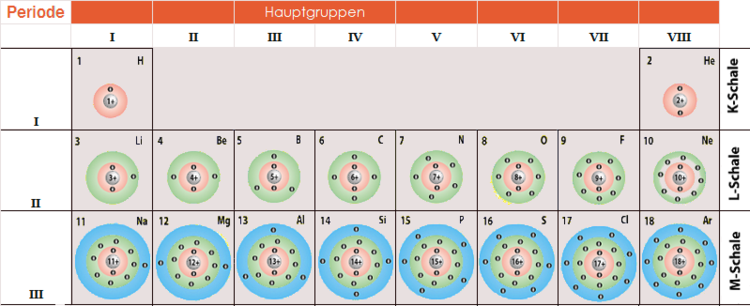
Man kann sich die Elektronenschalen wie konzentrische Kreise um den Atomkern vorstellen. Die innerste Schale (n=1) ist die energiereichste, und die Elektronen in den äußeren Schalen haben höhere Energien. Die Schalen werden mit den Buchstaben K, L, M, N usw. bezeichnet, wobei K der ersten Schale (n=1), L der zweiten Schale (n=2) usw. entspricht. Für Natrium sind die ersten beiden Schalen (K und L) vollständig gefüllt (2 bzw. 8 Elektronen), während die dritte Schale (M) nur ein Elektron enthält.
Valenzelektronen und chemische Reaktivität
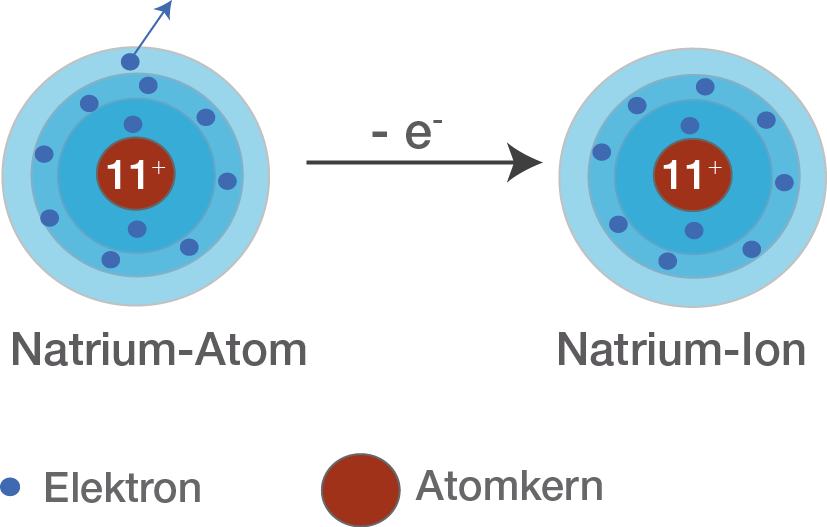
Das Elektron in der äußersten Schale (3s1) wird als Valenzelektron bezeichnet. Valenzelektronen sind für die chemischen Eigenschaften eines Elements verantwortlich. Natrium hat also ein Valenzelektron. Atome streben in der Regel danach, eine volle äußere Schale zu erreichen, da dies ein stabiler Zustand ist. Diese "volle" äußere Schale wird als Oktettregel bezeichnet (mit Ausnahme von Wasserstoff und Helium, die nach einer vollen ersten Schale mit 2 Elektronen streben).
Natrium erreicht eine volle äußere Schale, indem es sein einziges Valenzelektron abgibt. Dadurch erhält es eine positive Ladung und wird zu einem Natrium-Ion (Na+). Die Elektronenkonfiguration des Natrium-Ions ist 1s2 2s2 2p6, was der stabilen Elektronenkonfiguration des Edelgases Neon entspricht.
Die Abgabe des Valenzelektrons macht Natrium zu einem sehr reaktiven Metall. Es reagiert bereitwillig mit anderen Elementen, insbesondere mit solchen, die Elektronen aufnehmen wollen, um eine volle äußere Schale zu erreichen. Ein bekanntes Beispiel ist die Reaktion von Natrium mit Chlor, bei der Natriumchlorid (Kochsalz) entsteht:
2 Na (s) + Cl2 (g) → 2 NaCl (s)
In dieser Reaktion gibt jedes Natriumatom ein Elektron an ein Chloratom ab. Dadurch entstehen Natrium-Ionen (Na+) und Chlorid-Ionen (Cl-), die sich aufgrund ihrer entgegengesetzten Ladungen elektrostatisch anziehen und ein Ionengitter bilden, das das Natriumchlorid-Molekül darstellt.
Isotope des Natriums
Es ist wichtig zu beachten, dass Atome eines Elements unterschiedliche Anzahlen von Neutronen im Kern haben können. Diese Varianten werden als Isotope bezeichnet. Obwohl die Anzahl der Neutronen variieren kann, ändert sich die Anzahl der Protonen (und damit die Anzahl der Elektronen) nicht, da dies das Element verändern würde. Das häufigste Isotop des Natriums ist Natrium-23 (23Na), das 11 Protonen und 12 Neutronen im Kern hat. Es gibt auch andere Isotope von Natrium, wie z.B. Natrium-22 (22Na) und Natrium-24 (24Na), die radioaktiv sind.
Die Anzahl der Elektronen in einem Atom bestimmt seine chemischen Eigenschaften. Da alle Isotope eines Elements die gleiche Anzahl an Protonen und Elektronen haben, haben sie auch ähnliche chemische Eigenschaften. Die Unterschiede in der Anzahl der Neutronen beeinflussen hauptsächlich die physikalischen Eigenschaften, wie z.B. die Masse und die Stabilität des Kerns.
Die Bedeutung der Elektronenanzahl für das Verständnis von Natrium
Das Wissen um die Anzahl der Elektronen im Natriumatom und deren Anordnung ist grundlegend für das Verständnis seiner chemischen Eigenschaften und Reaktionen. Die Tatsache, dass Natrium ein Valenzelektron besitzt, erklärt seine hohe Reaktivität und seine Tendenz, Ionen zu bilden. Dieses Wissen ist unerlässlich in verschiedenen Bereichen, wie z.B.:
- Chemie: Zum Verständnis von chemischen Bindungen, Reaktionen und der Bildung von chemischen Verbindungen.
- Materialwissenschaft: Zur Entwicklung neuer Materialien mit spezifischen Eigenschaften.
- Biologie: Natrium spielt eine wichtige Rolle in biologischen Prozessen, z.B. bei der Nervenleitung und dem Flüssigkeitshaushalt.
- Medizin: Natrium ist ein wichtiger Elektrolyt, dessen Konzentration im Körper reguliert werden muss.
Zusammenfassend lässt sich sagen, dass ein neutrales Natriumatom 11 Elektronen besitzt, die in einer bestimmten Elektronenkonfiguration angeordnet sind. Das einzelne Valenzelektron ist für die hohe Reaktivität des Elements verantwortlich und prägt seine Rolle in vielen chemischen und biologischen Prozessen.

![Wie Viele Elektronen Hat Natrium Schalenmodell • Aufbau und Elektronenschalen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/03/WP_Schalenmodell_Schalenmodell-Alkalimetalle-1024x576.jpg)