Wie Viele Elektronen Hat Sauerstoff
Hallo liebe Reisefreunde! Stellt euch vor, ihr steht in den majestätischen Alpen, die Luft ist frisch und klar, und ihr atmet tief ein. Was ihr da einatmet, ist zu einem großen Teil Sauerstoff. Und genau um diesen Sauerstoff, genauer gesagt um seine Elektronen, soll es heute gehen. Keine Sorge, wir tauchen nicht in komplizierte Chemie ein, sondern betrachten das Ganze mit den Augen eines neugierigen Reisenden, der sich fragt: Was steckt eigentlich hinter all den Dingen, die uns umgeben?
Vielleicht denkt ihr jetzt: "Elektronen? Was hat das denn mit Reisen zu tun?" Mehr, als man vielleicht auf den ersten Blick vermutet! Das Verständnis grundlegender wissenschaftlicher Prinzipien, wie z.B. die Struktur von Atomen, kann unsere Wertschätzung für die Welt um uns herum vertiefen. Und wer weiß, vielleicht inspiriert es euch sogar, euer nächstes Reiseziel unter einem ganz neuen Blickwinkel zu betrachten.
Sauerstoff: Mehr als nur zum Atmen
Sauerstoff, lateinisch Oxygenium, ist ein chemisches Element, das uns überall begegnet. Wir brauchen es zum Atmen, Pflanzen brauchen es für die Photosynthese, und Feuer braucht es zum Brennen. Es ist das dritthäufigste Element im Universum und macht fast 21% der Erdatmosphäre aus. Aber was macht Sauerstoff so besonders? Ein wichtiger Faktor ist seine atomare Struktur, insbesondere die Anzahl seiner Elektronen.
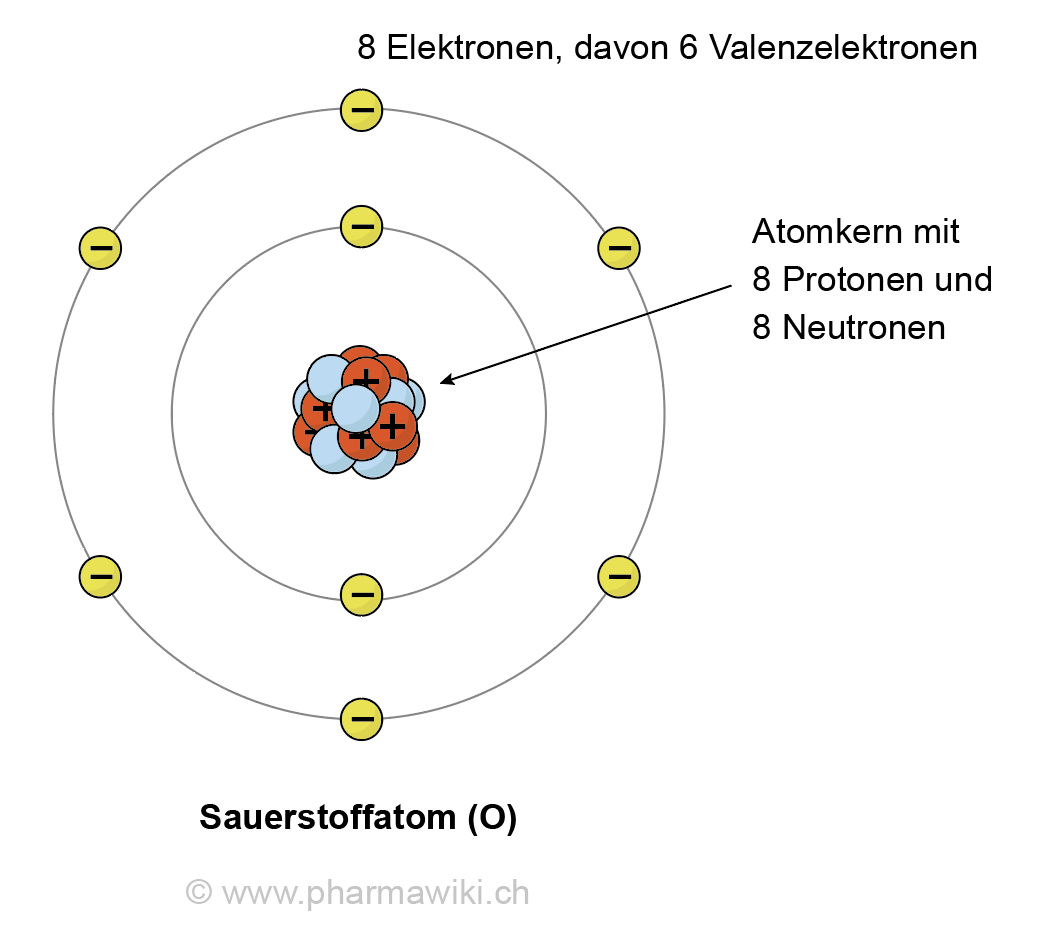
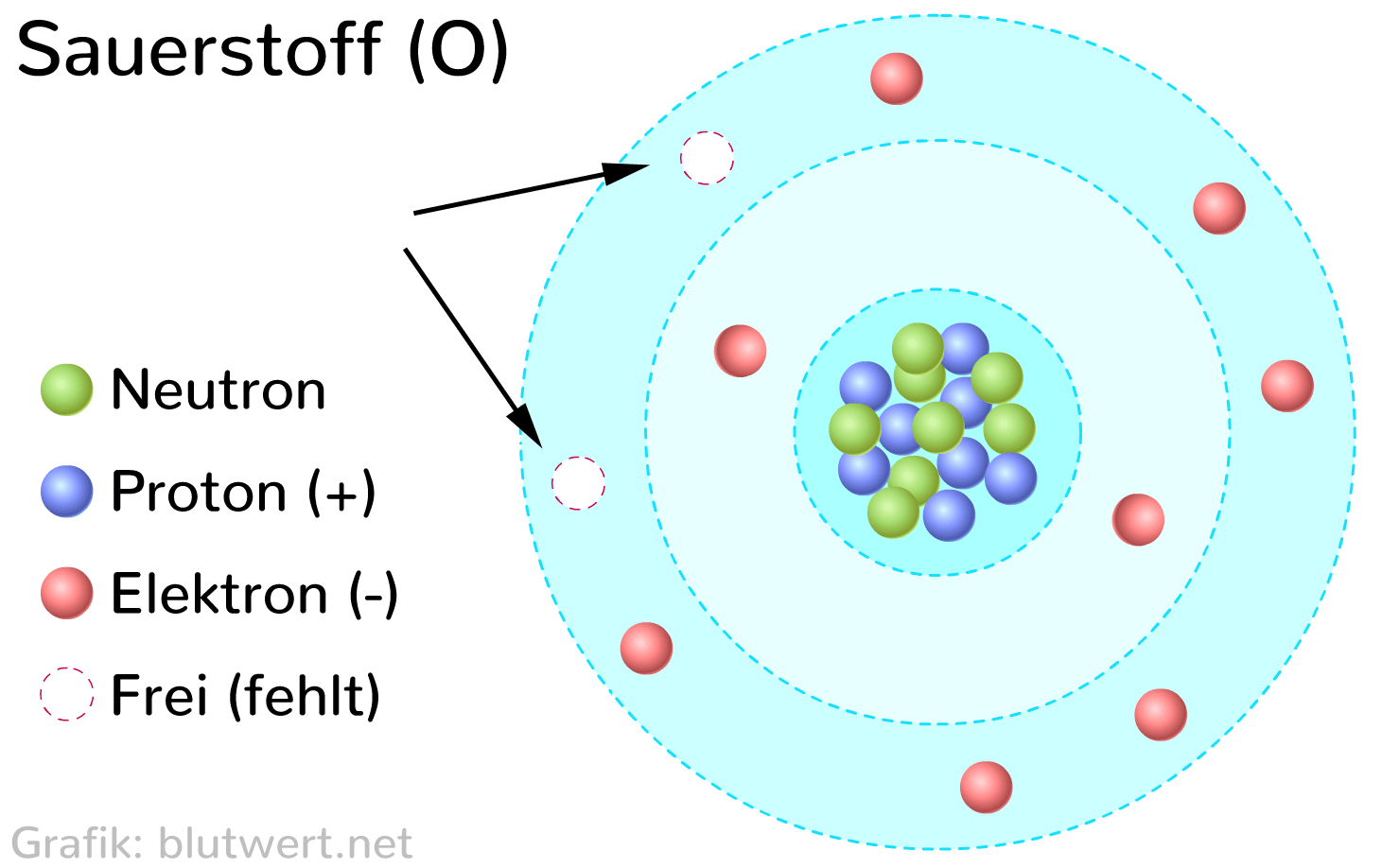
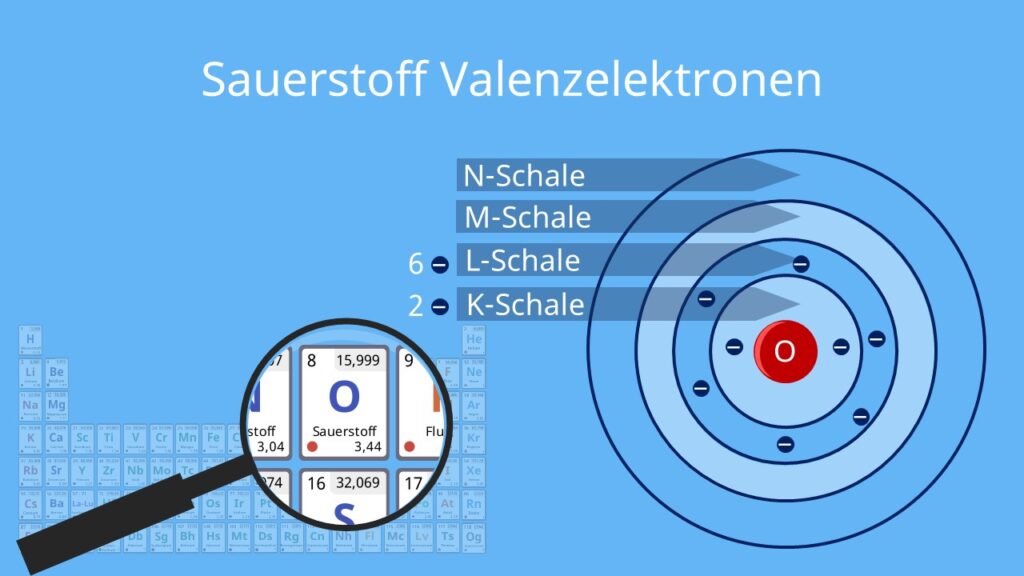
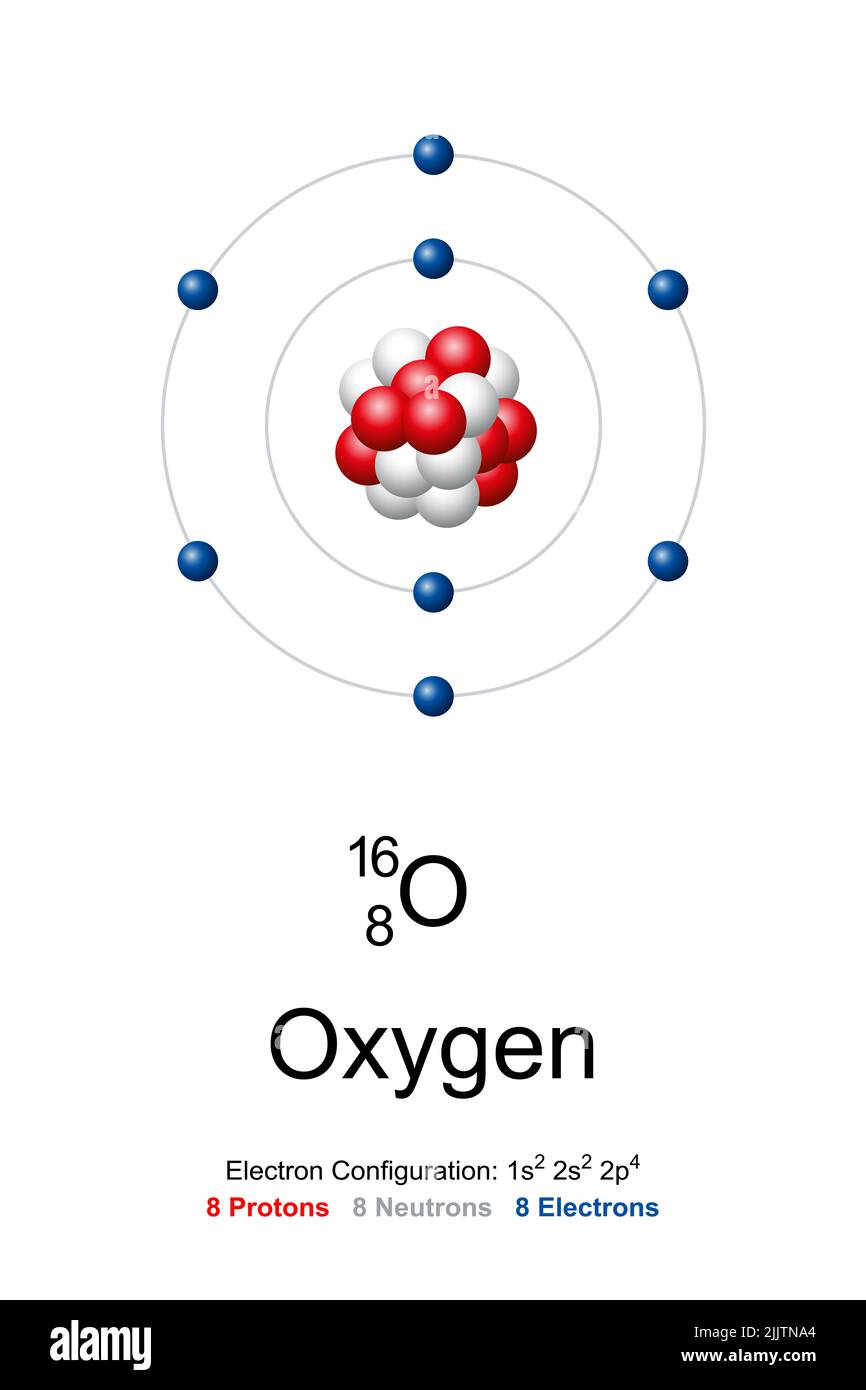
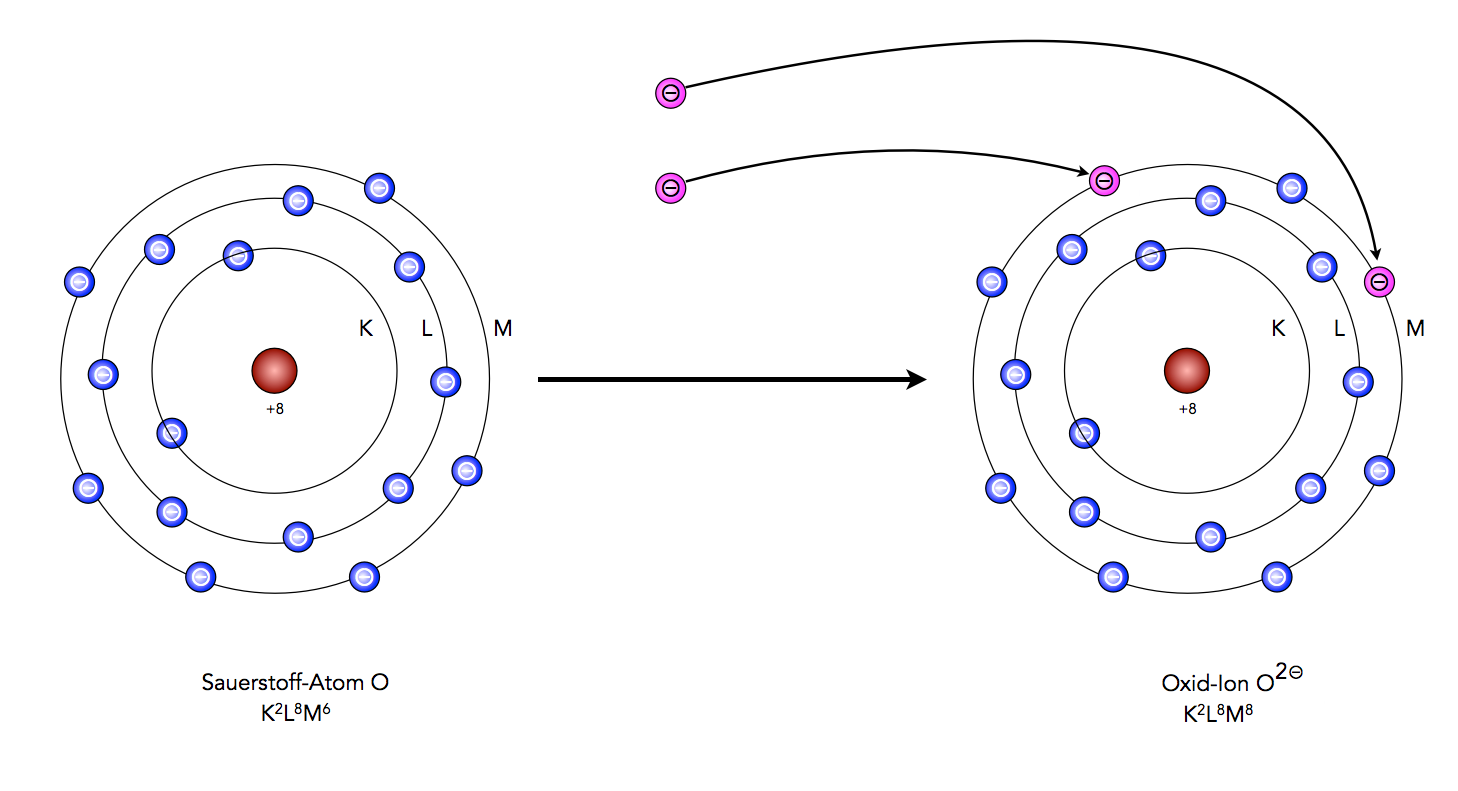
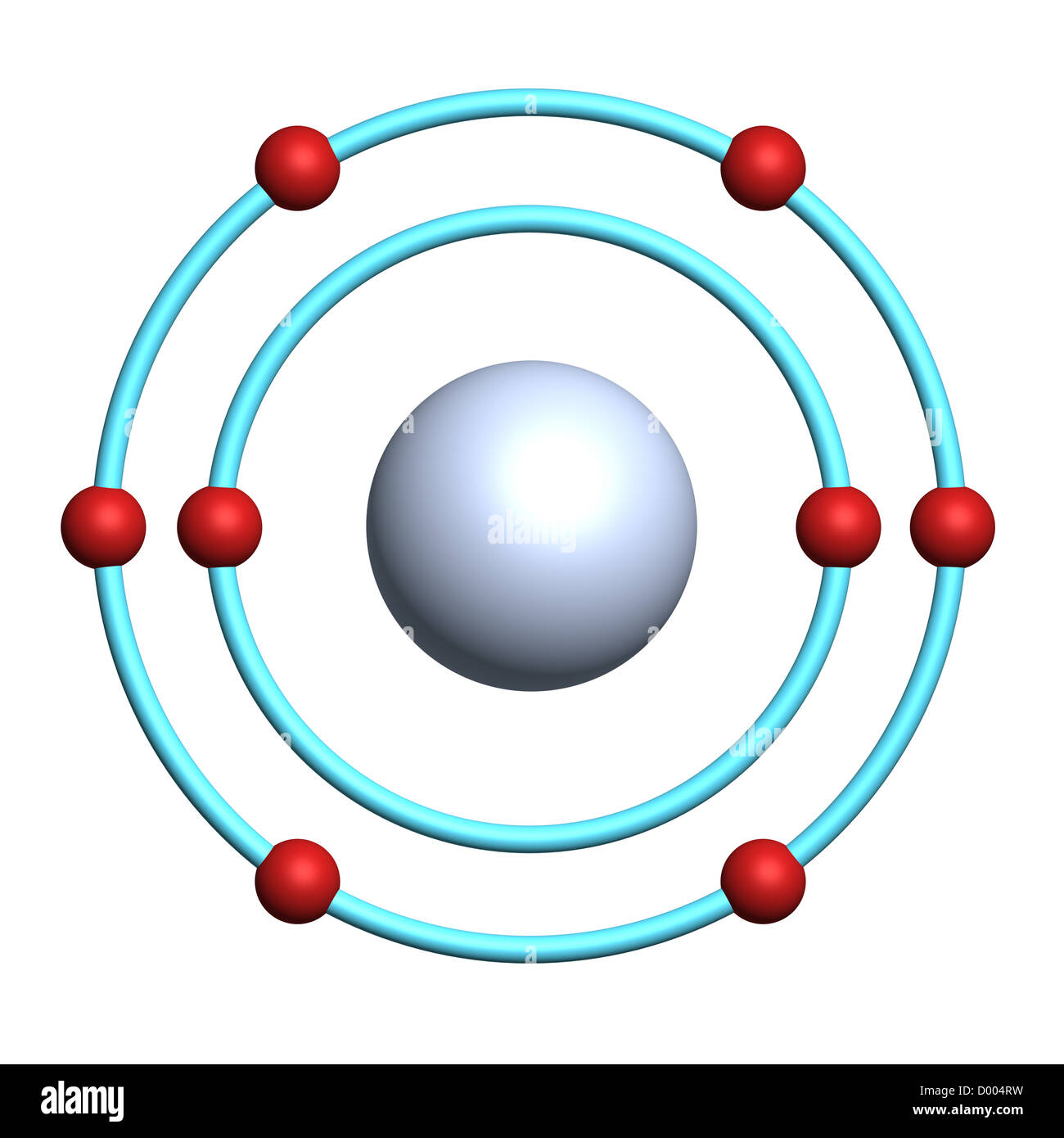
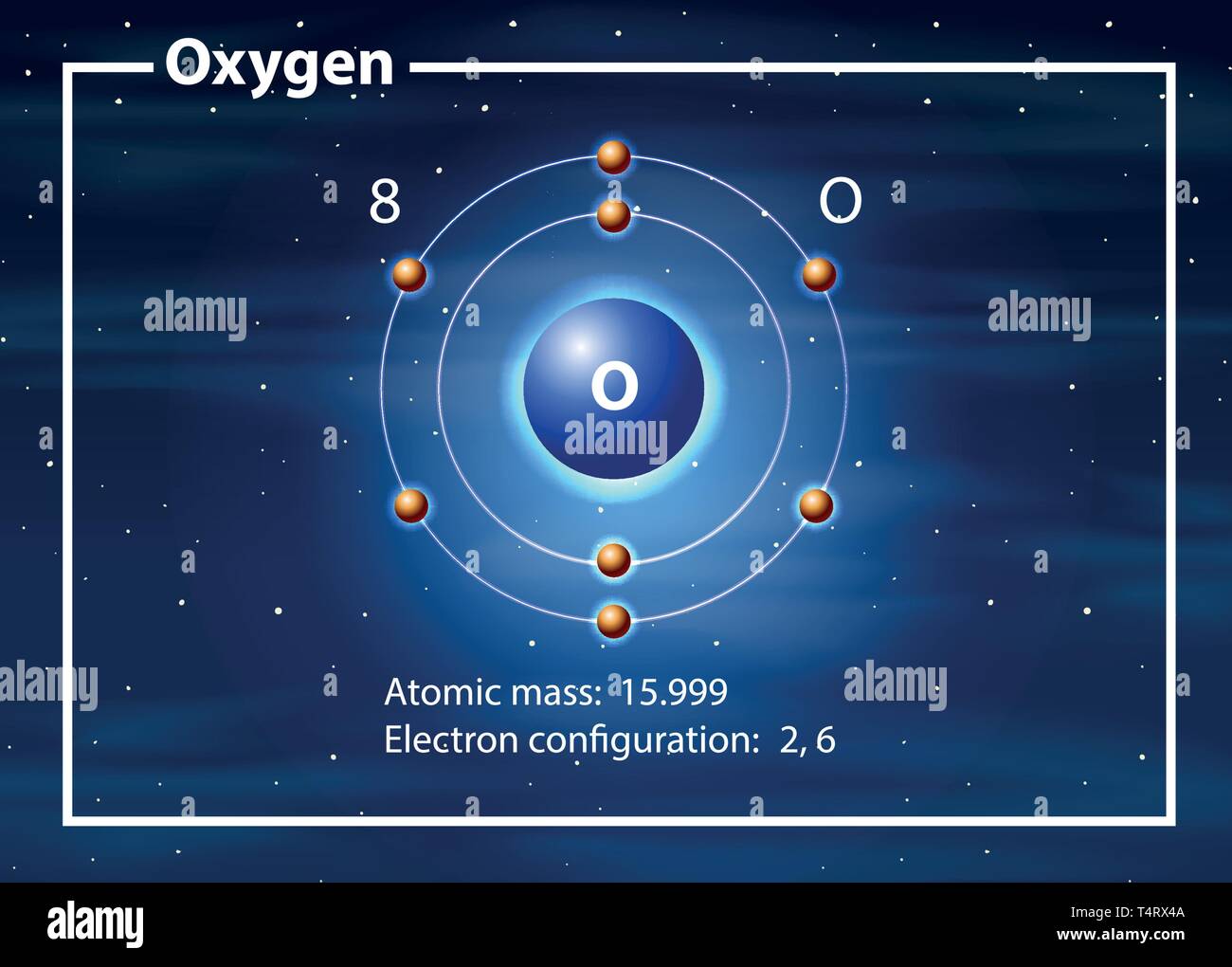
Um die Frage gleich vorwegzunehmen: Ein Sauerstoffatom hat acht Elektronen. Aber das ist nur die halbe Wahrheit. Denn diese acht Elektronen sind nicht einfach wahllos um den Atomkern verteilt. Sie sind in bestimmten Schalen und Orbitalen angeordnet, was die chemischen Eigenschaften von Sauerstoff maßgeblich beeinflusst.
Ein kurzer Ausflug in die Atomphysik (aber keine Angst!)
Erinnert ihr euch noch an euren Chemieunterricht? Keine Panik, ich werde euch nicht mit Formeln und komplizierten Theorien langweilen. Aber ein paar Grundlagen sind wichtig, um zu verstehen, warum Sauerstoff acht Elektronen hat und warum das so wichtig ist.
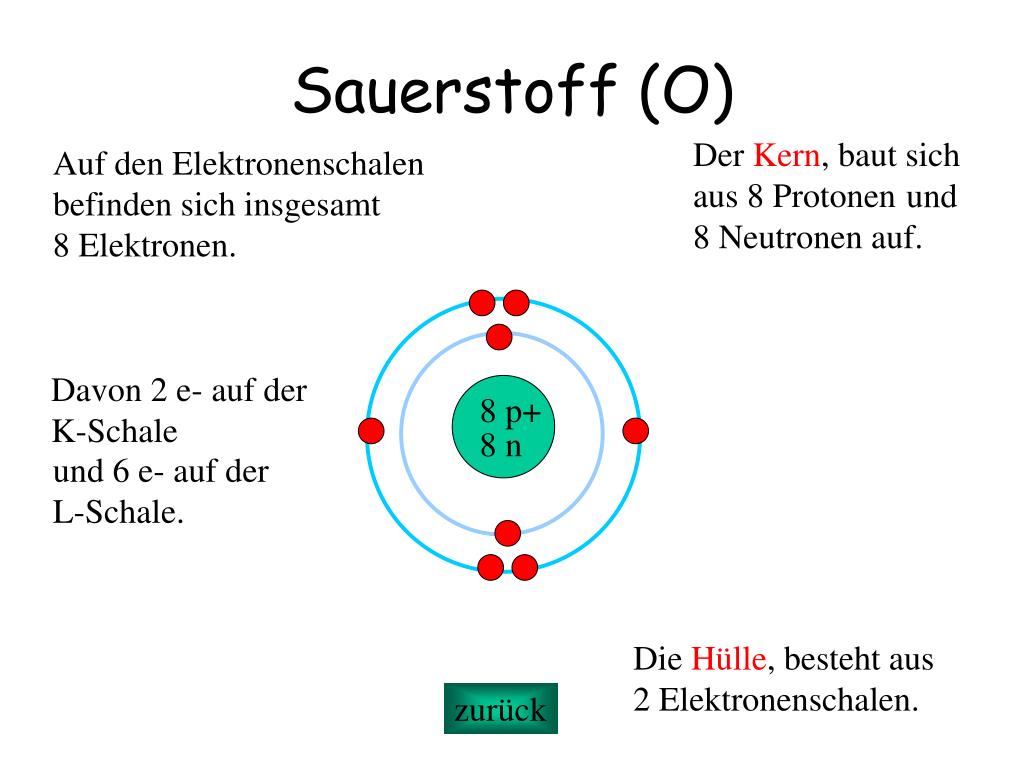
Stellt euch ein Atom wie ein Mini-Sonnensystem vor. Im Zentrum befindet sich der Kern, der aus positiv geladenen Protonen und neutralen Neutronen besteht. Um diesen Kern kreisen die negativ geladenen Elektronen in bestimmten Bahnen, den sogenannten Elektronenschalen. Die Anzahl der Protonen im Kern bestimmt, um welches Element es sich handelt. Sauerstoff hat acht Protonen, daher auch der Name.
Die Elektronen sind nun in Schalen um den Kern angeordnet. Die erste Schale kann maximal zwei Elektronen aufnehmen, die zweite Schale maximal acht. Sauerstoff hat also zwei Elektronen in der ersten Schale und sechs in der zweiten. Diese Verteilung ist entscheidend, denn sie erklärt, warum Sauerstoff so reaktionsfreudig ist.
Die Oktettregel und Sauerstoff's Drang nach Vollständigkeit
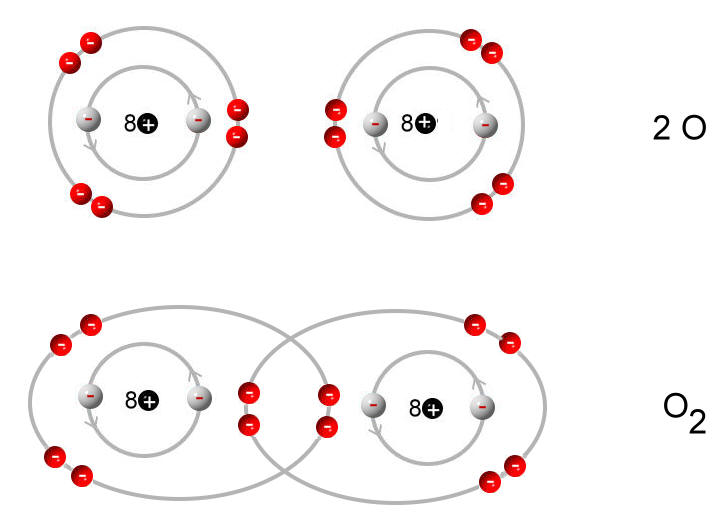
Atome streben nach Stabilität. Sie wollen ihre äußere Elektronenschale, die sogenannte Valenzschale, vollständig gefüllt haben. Die Oktettregel besagt, dass Atome in der Regel acht Elektronen in ihrer Valenzschale haben wollen (Ausnahmen bestätigen die Regel). Sauerstoff hat aber nur sechs. Das bedeutet, ihm fehlen zwei Elektronen, um sein Oktett zu vervollständigen.
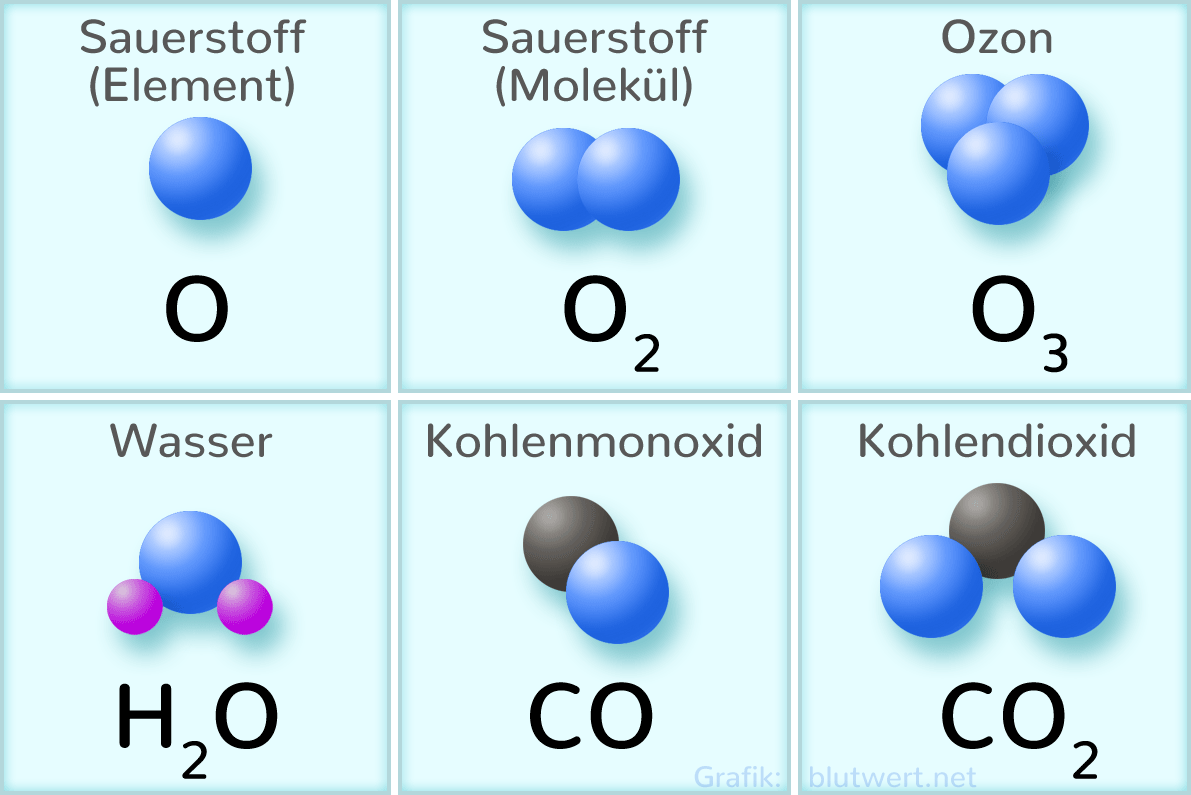
Und hier kommt die Reaktionsfreudigkeit von Sauerstoff ins Spiel. Um die fehlenden Elektronen zu bekommen, geht Sauerstoff gerne Bindungen mit anderen Atomen ein. Er "klaut" quasi Elektronen, oder teilt sie mit anderen Atomen, um seine Valenzschale zu füllen. Das erklärt, warum Sauerstoff so viele Verbindungen eingeht, wie z.B. mit Wasserstoff zu Wasser (H2O) oder mit Kohlenstoff zu Kohlendioxid (CO2).
Stellt euch vor, Sauerstoff ist wie ein Reisender, der auf der Suche nach dem perfekten Souvenir ist, um seine Sammlung zu vervollständigen. Er ist bereit, dafür einiges zu tun, und geht dafür Beziehungen mit anderen Reisenden ein (Atomen in diesem Fall).
Warum ist das wichtig für uns Reisende?
Nun, vielleicht fragt ihr euch immer noch, was das alles mit Reisen zu tun hat. Aber denkt mal darüber nach: Die Art und Weise, wie Sauerstoff mit anderen Elementen reagiert, beeinflusst viele Aspekte unseres Lebens und damit auch unsere Reiseerlebnisse.
- Atmung: Ohne Sauerstoff keine Atmung. Egal ob ihr in den Anden wandert oder am Strand entspannt, ihr seid auf die Sauerstoffversorgung angewiesen. Die chemischen Reaktionen in unseren Zellen, die uns Energie liefern, benötigen Sauerstoff.
- Verbrennung: Sauerstoff ist essentiell für die Verbrennung. Denkt an Lagerfeuer, Kocher beim Camping oder die Motoren von Flugzeugen und Autos. Ohne Sauerstoff würde nichts davon funktionieren.
- Korrosion: Sauerstoff ist auch für die Korrosion von Metallen verantwortlich. Denkt an Rost an alten Schiffen oder Fahrrädern. Die Reaktion von Eisen mit Sauerstoff und Wasser führt zur Bildung von Rost.
- Die Ozonschicht: Die Ozonschicht in der Stratosphäre schützt uns vor schädlicher UV-Strahlung. Ozon (O3) ist eine Form von Sauerstoff, bei der drei Sauerstoffatome miteinander verbunden sind.
Wenn ihr also das nächste Mal ein Lagerfeuer entzündet, tief Luft holt oder ein rostige Schiffswrack bewundert, denkt an die acht Elektronen des Sauerstoffs und die faszinierenden chemischen Prozesse, die sich dahinter verbergen. Sie sind ein wesentlicher Bestandteil der Welt, die wir bereisen und entdecken.
Ein kleiner Ausblick: Sauerstoff und das Leben auf anderen Planeten
Die Suche nach Leben auf anderen Planeten konzentriert sich oft auf die Suche nach Sauerstoff. Eine sauerstoffreiche Atmosphäre könnte ein Hinweis auf biologische Aktivität sein. Auch wenn Leben nicht unbedingt Sauerstoff zum Überleben benötigt, wie wir es kennen, so ist er doch ein wichtiges Indiz. Vielleicht werden wir eines Tages Reisen zu Planeten unternehmen, auf denen wir auf außerirdisches Leben treffen, das auf Sauerstoff basiert. Die Vorstellung ist doch faszinierend, oder?
Ich hoffe, dieser kleine Ausflug in die Welt der Elektronen und des Sauerstoffs hat euch gefallen. Denkt daran, Reisen bedeutet nicht nur, neue Orte zu sehen, sondern auch, die Welt um uns herum besser zu verstehen. Und wer weiß, vielleicht inspiriert euch das ja, euch auf eure nächste Reise etwas genauer mit den wissenschaftlichen Grundlagen eurer Reiseziele auseinanderzusetzen. Bis zum nächsten Mal und gute Reise!


![Wie Viele Elektronen Hat Sauerstoff Schalenmodell • Aufbau und Elektronenschalen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/03/WP_Schalenmodell_1_sauerstoff-1-1024x576.jpg)


![Wie Viele Elektronen Hat Sauerstoff Sauerstoff • einfach erklärt: Steckbrief, Nachweis · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/04/Sauerstoff-Schalenmodell-1024x576.jpg)