Wie Viele Elektronen Passen Auf Die Schalen
Viele naturwissenschaftliche Konzepte können zunächst kompliziert erscheinen. Das Verständnis der Elektronenverteilung auf den Elektronenschalen eines Atoms ist jedoch grundlegend für das Verständnis chemischer Reaktionen und Bindungen. Dieser Artikel bietet eine klare und prägnante Erklärung, wie viele Elektronen auf die verschiedenen Schalen eines Atoms passen.
Grundlagen der Atomstruktur
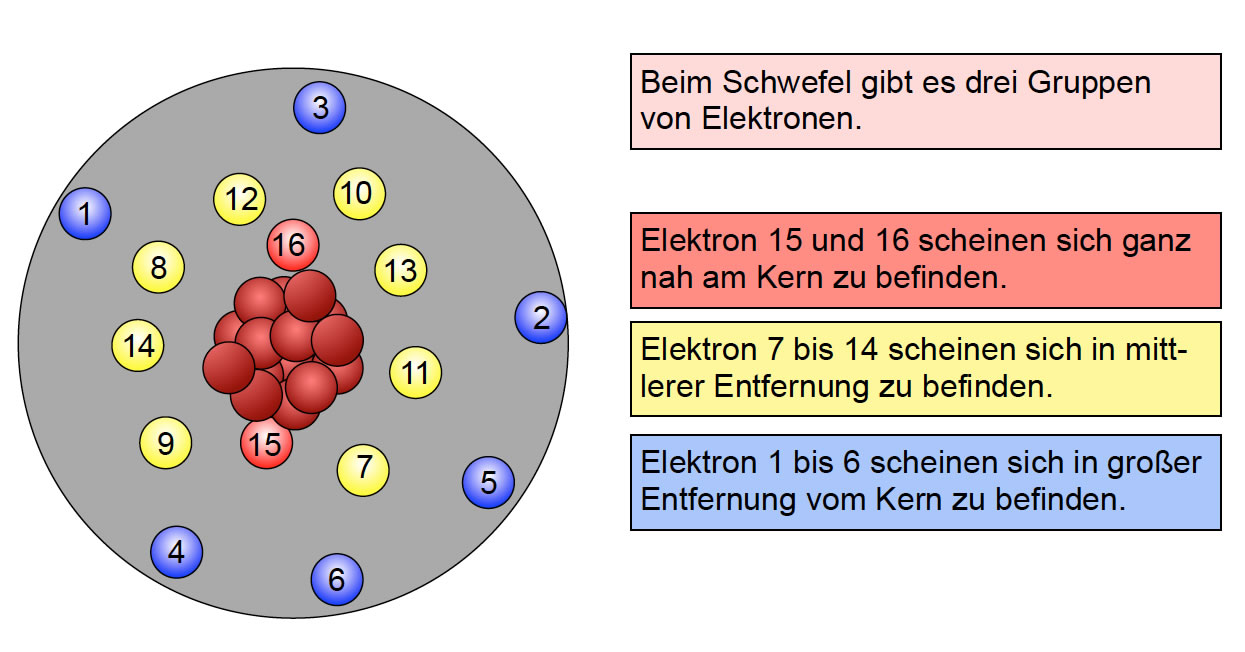
Bevor wir uns der Elektronenverteilung zuwenden, ist es wichtig, die grundlegende Struktur eines Atoms zu verstehen. Ein Atom besteht aus einem Kern (Nukleus) und Elektronenschalen, die den Kern umgeben.
- Der Kern enthält positiv geladene Protonen und neutrale Neutronen. Die Anzahl der Protonen bestimmt das Element.
- Die Elektronenschalen sind Bereiche um den Kern, in denen sich die Elektronen aufhalten. Elektronen sind negativ geladen.
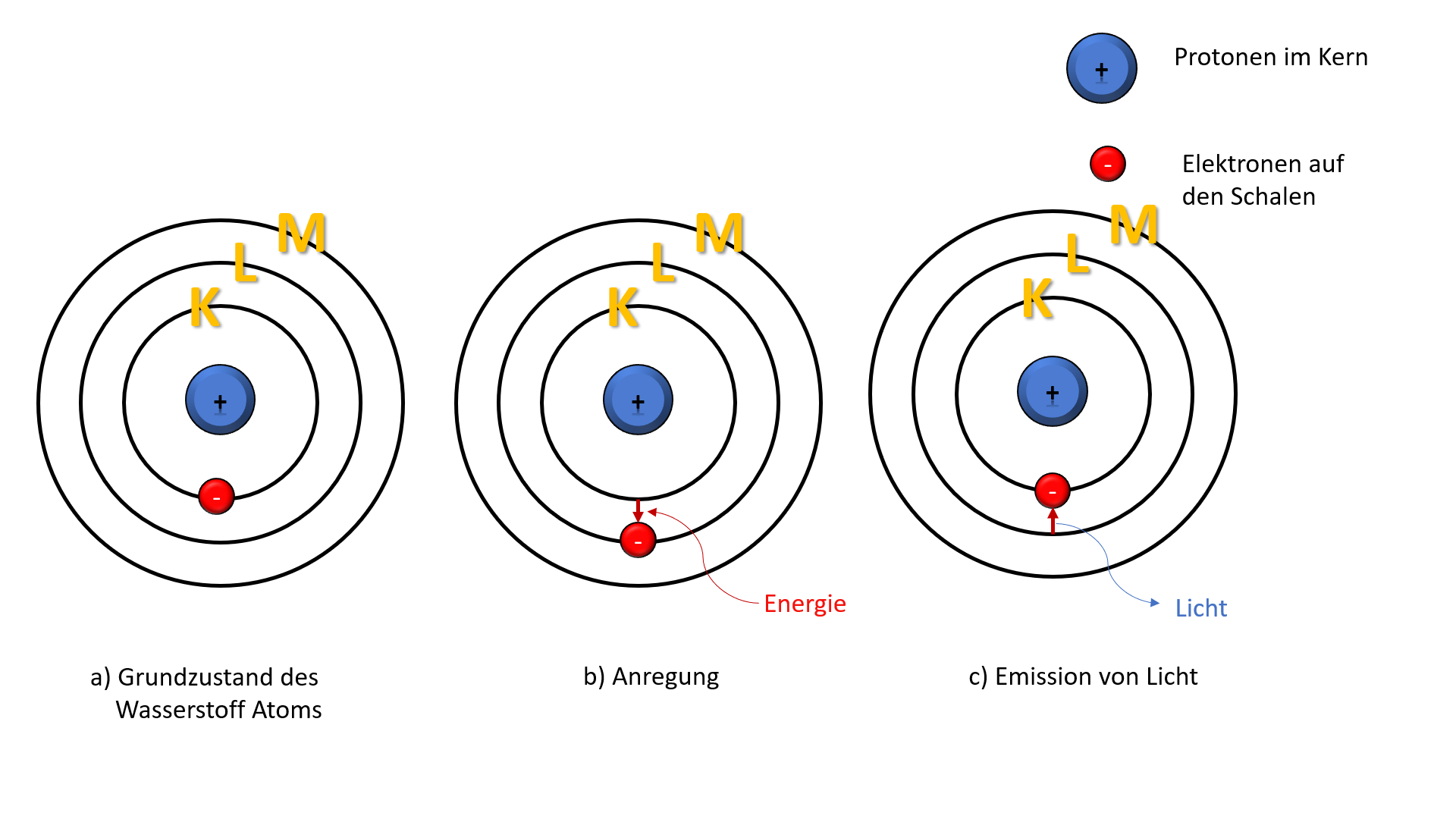
Elektronen bewegen sich nicht auf festen Bahnen, sondern befinden sich eher in bestimmten Wahrscheinlichkeitsräumen, die als Orbitale bezeichnet werden. Die Elektronenschalen stellen Energieniveaus dar. Je weiter eine Schale vom Kern entfernt ist, desto höher ist ihr Energieniveau.
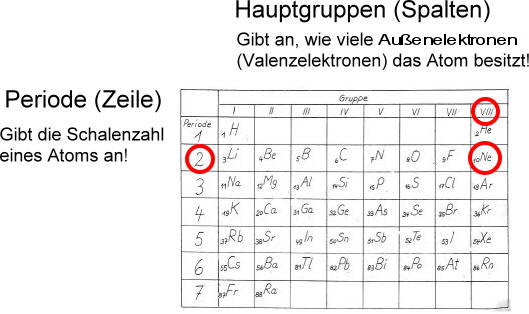
Die (2n²) Regel: Maximale Anzahl von Elektronen pro Schale
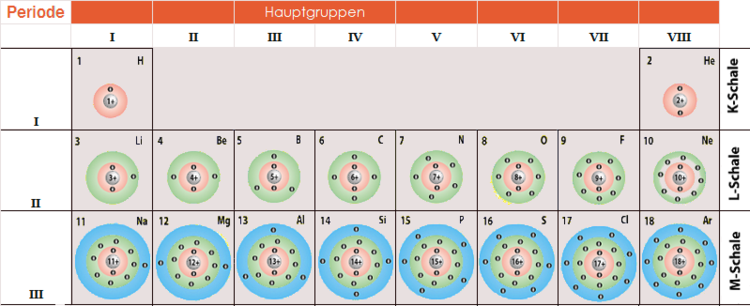
Die maximale Anzahl an Elektronen, die jede Schale aufnehmen kann, wird durch die Formel 2n² bestimmt, wobei 'n' die Schalennummer ist. Die Schalen werden beginnend mit der Schale, die dem Kern am nächsten ist, nummeriert (n = 1, 2, 3 usw.). Manchmal werden die Schalen auch mit Buchstaben bezeichnet (K, L, M, N usw.).
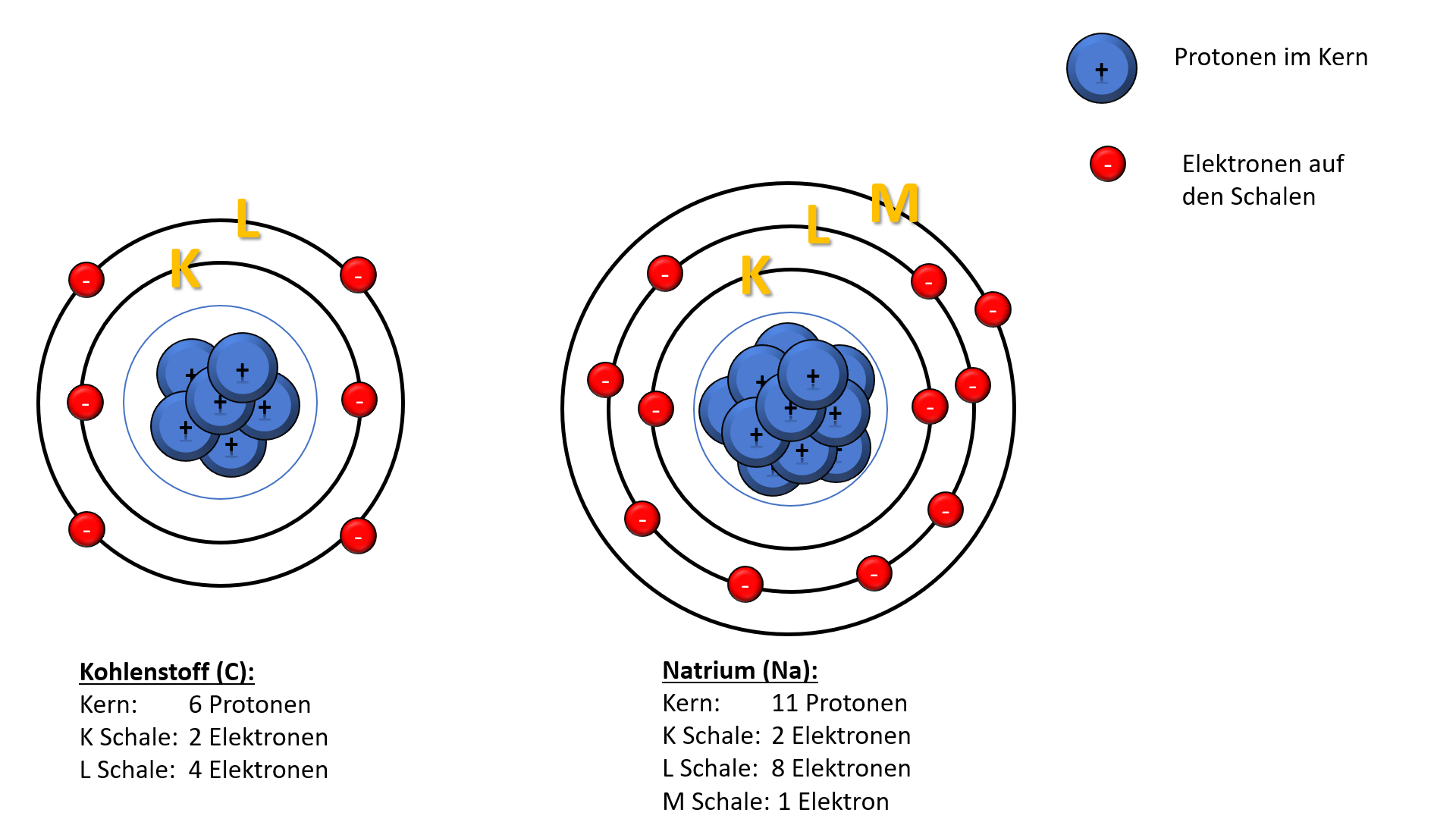
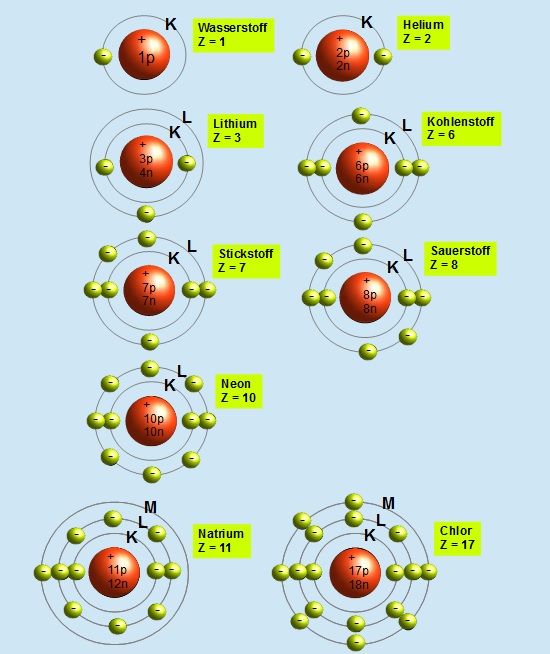
Die K-Schale (n=1)
Die K-Schale ist die innerste Schale und kann maximal 2 Elektronen aufnehmen.
Berechnung: 2 * (1)² = 2
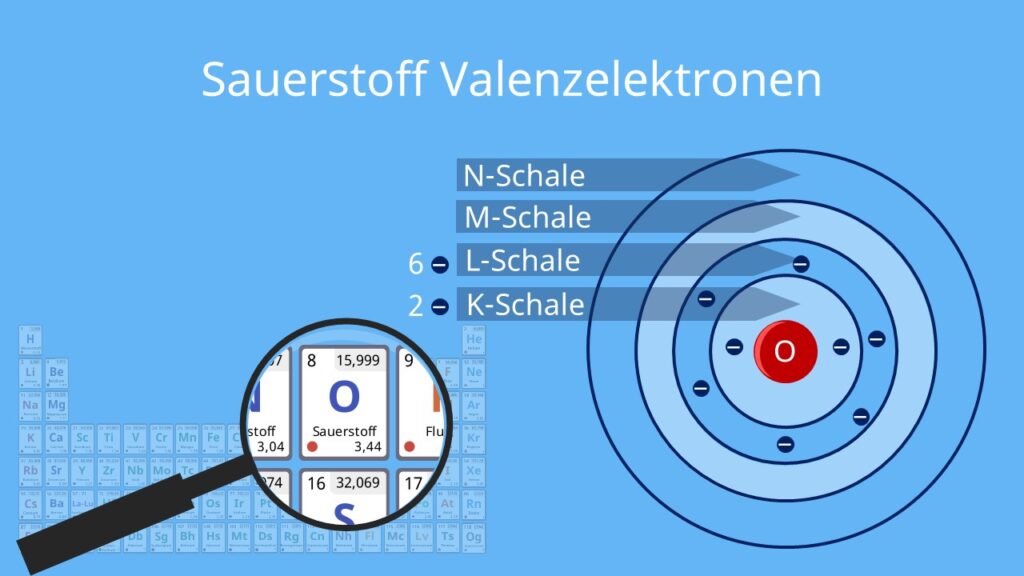
Die L-Schale (n=2)
Die L-Schale ist die zweite Schale und kann maximal 8 Elektronen aufnehmen.
Berechnung: 2 * (2)² = 8
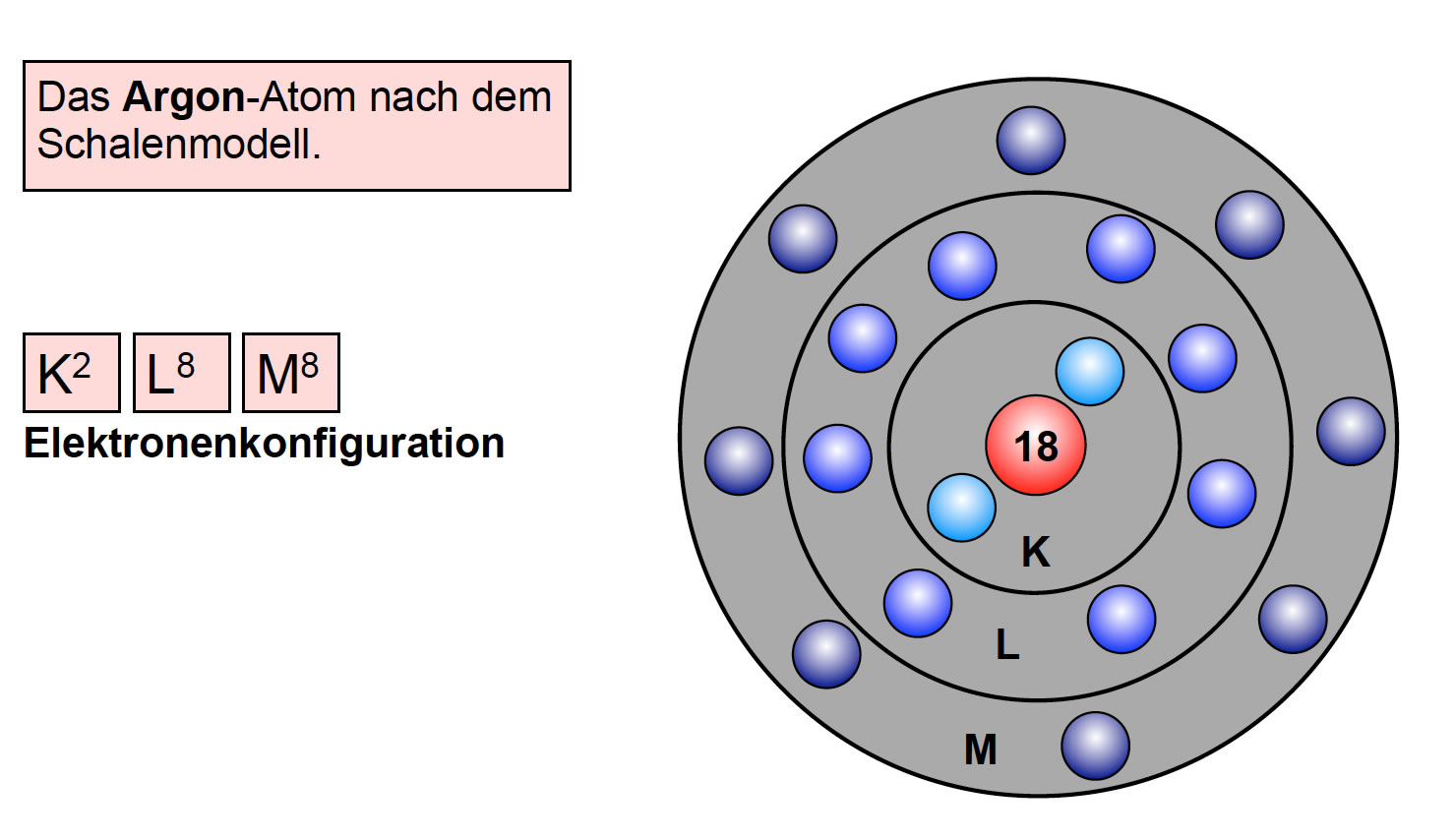
Die M-Schale (n=3)
Die M-Schale ist die dritte Schale und kann maximal 18 Elektronen aufnehmen.
Berechnung: 2 * (3)² = 18
Die N-Schale (n=4)
Die N-Schale ist die vierte Schale und kann maximal 32 Elektronen aufnehmen.
Berechnung: 2 * (4)² = 32
Die O-Schale (n=5)
Die O-Schale ist die fünfte Schale und kann maximal 50 Elektronen aufnehmen.
Berechnung: 2 * (5)² = 50
Die P-Schale (n=6)
Die P-Schale ist die sechste Schale und kann maximal 72 Elektronen aufnehmen.
Berechnung: 2 * (6)² = 72
Die Q-Schale (n=7)
Die Q-Schale ist die siebte Schale und kann maximal 98 Elektronen aufnehmen.
Berechnung: 2 * (7)² = 98
Obwohl die 2n²-Regel die maximale theoretische Kapazität jeder Schale angibt, ist es wichtig zu beachten, dass die Elektronenkonfiguration in realen Atomen oft komplexer ist und von anderen Faktoren beeinflusst wird, wie z.B. der energetischen Stabilität der Orbitale.
Die Oktettregel: Stabilität durch volle äußere Schalen
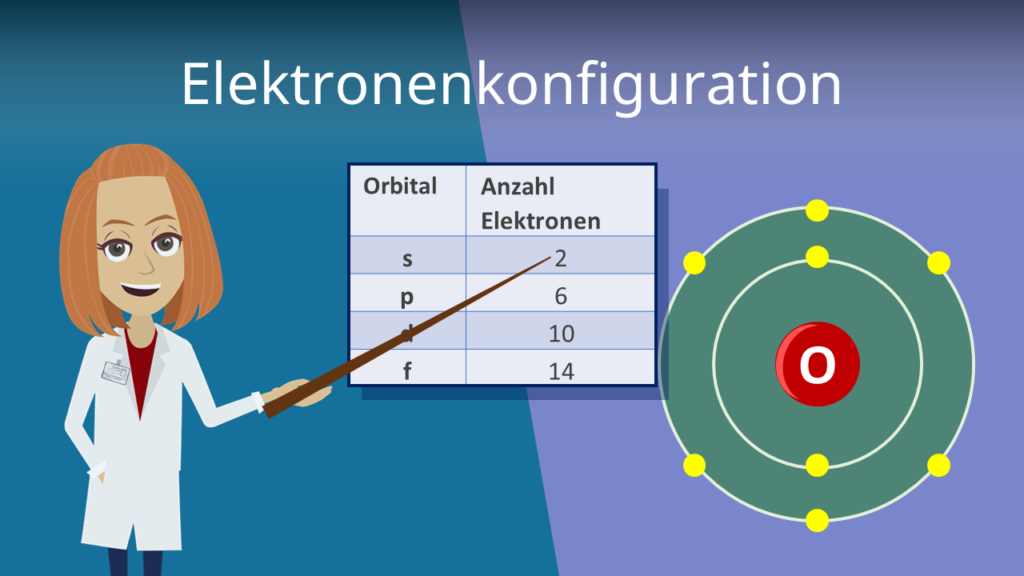
Neben der maximalen Anzahl von Elektronen pro Schale ist die Oktettregel ein wichtiges Konzept. Sie besagt, dass Atome danach streben, eine vollständig gefüllte äußere (Valenz-)Schale zu haben, typischerweise mit 8 Elektronen (mit Ausnahme von Wasserstoff und Helium, die mit 2 Elektronen in der K-Schale zufrieden sind).
Die Oktettregel erklärt, warum Atome chemische Bindungen eingehen. Atome können Elektronen teilen (kovalente Bindungen), Elektronen abgeben (um positiv geladene Ionen zu bilden) oder Elektronen aufnehmen (um negativ geladene Ionen zu bilden), um eine stabile Elektronenkonfiguration zu erreichen.
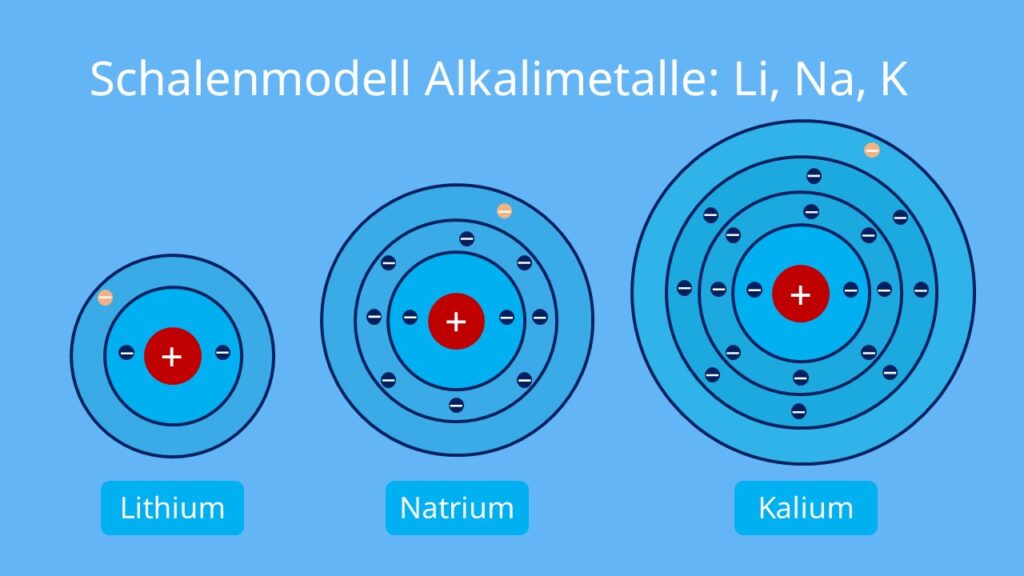
Betrachten wir das Beispiel von Natrium (Na) und Chlor (Cl). Natrium hat 11 Elektronen und die Elektronenkonfiguration 2-8-1. Chlor hat 17 Elektronen und die Elektronenkonfiguration 2-8-7. Natrium kann ein Elektron abgeben, um eine stabile 2-8 Konfiguration zu erreichen, während Chlor ein Elektron aufnehmen kann, um eine stabile 2-8-8 Konfiguration zu erreichen. Diese Tendenz führt zur Bildung von Natriumchlorid (NaCl), besser bekannt als Kochsalz.
Ausnahmen von der Regel: Übergangsmetalle
Die 2n²-Regel und die Oktettregel sind nützliche Richtlinien, aber es gibt Ausnahmen, insbesondere bei den Übergangsmetallen. Übergangsmetalle haben d-Orbitale, die zusätzliche Komplexität in ihre Elektronenkonfiguration einführen. Die Füllreihenfolge der d-Orbitale kann von den einfachen Regeln abweichen, was zu ungewöhnlichen Elektronenkonfigurationen und unterschiedlichen Oxidationsstufen führt.
Beispielsweise weisen Chrom (Cr) und Kupfer (Cu) in ihrer Elektronengrundkonfiguration Abweichungen auf, um eine höhere Stabilität zu erreichen.
Wie man die Elektronenkonfiguration bestimmt
Die Bestimmung der Elektronenkonfiguration eines Atoms erfordert ein gewisses Verständnis der Atomstruktur und der Füllreihenfolge der Orbitale. Hier sind die grundlegenden Schritte:
- Bestimme die Anzahl der Elektronen: Die Anzahl der Elektronen in einem neutralen Atom entspricht der Anzahl der Protonen (Atomzahl).
- Fülle die Schalen der Reihe nach: Beginne mit der innersten Schale (K-Schale) und fülle die Schalen nacheinander, wobei du die maximale Anzahl von Elektronen pro Schale beachtest (2n²-Regel).
- Berücksichtige die Oktettregel: Atome streben nach einer vollen äußeren Schale mit 8 Elektronen (außer Wasserstoff und Helium).
- Beachte Ausnahmen: Sei dir bewusst, dass es bei Übergangsmetallen Ausnahmen von den einfachen Regeln gibt.
Bedeutung der Elektronenkonfiguration
Die Elektronenkonfiguration ist von großer Bedeutung, da sie die chemischen Eigenschaften eines Elements bestimmt. Die Anzahl der Valenzelektronen (Elektronen in der äußersten Schale) bestimmt, wie ein Atom mit anderen Atomen interagiert und welche Art von Bindungen es eingehen kann. Das Verständnis der Elektronenkonfiguration hilft, chemische Reaktionen vorherzusagen und zu erklären, warum bestimmte Elemente bestimmte Eigenschaften aufweisen.
Zusammenfassung
Die Verteilung der Elektronen auf die Elektronenschalen eines Atoms folgt bestimmten Regeln, die durch die Quantenmechanik bestimmt werden. Die 2n²-Regel gibt die maximale Anzahl an Elektronen an, die jede Schale aufnehmen kann, während die Oktettregel die Tendenz von Atomen beschreibt, eine volle äußere Schale zu erreichen. Obwohl es Ausnahmen von diesen Regeln gibt, bieten sie ein grundlegendes Verständnis der Atomstruktur und der chemischen Bindung.
Durch das Verständnis dieser Konzepte können Sie besser verstehen, wie Atome interagieren und wie chemische Reaktionen ablaufen. Dieses Wissen ist entscheidend für viele Bereiche der Wissenschaft, einschließlich Chemie, Physik und Materialwissenschaften.

![Wie Viele Elektronen Passen Auf Die Schalen Schalenmodell • Aufbau und Elektronenschalen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/03/WP_Schalenmodell_1_sauerstoff-1-1024x576.jpg)
![Wie Viele Elektronen Passen Auf Die Schalen Schalenmodell • Aufbau und Elektronenschalen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/03/WP_Schalenmodell_4_halogene-2-1024x576.jpg)




![Wie Viele Elektronen Passen Auf Die Schalen Schalenmodell • Aufbau und Elektronenschalen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/03/WP_Schalenmodell_6_schalen-1024x576.jpg)