Wie Viele Elektronen Passen In Die 5 Schale

Willkommen zurück zu unserem kleinen Ausflug in die faszinierende Welt der Chemie! Heute begeben wir uns auf eine Entdeckungsreise, die vielleicht etwas abstrakter klingt, als ein Spaziergang durch den Englischen Garten, aber trotzdem unglaublich spannend ist. Wir sprechen über die 5. Elektronenschale – oder, wie der Chemiker sagen würde, die 'O-Schale' – und wie viele Elektronen dort eigentlich Platz finden. Keine Sorge, wir halten es einfach und verständlich, versprochen!
Was sind überhaupt Elektronenschalen?
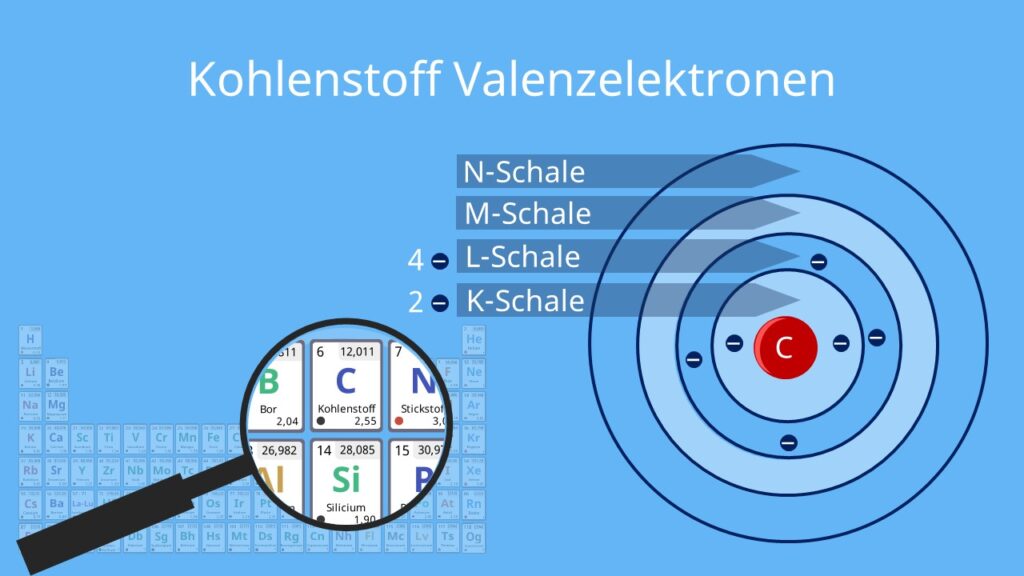
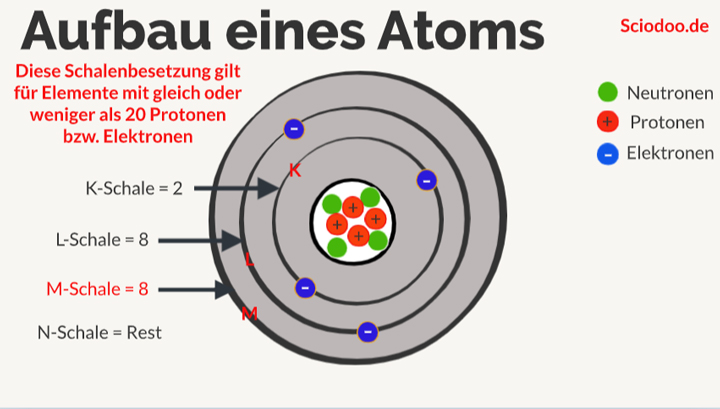
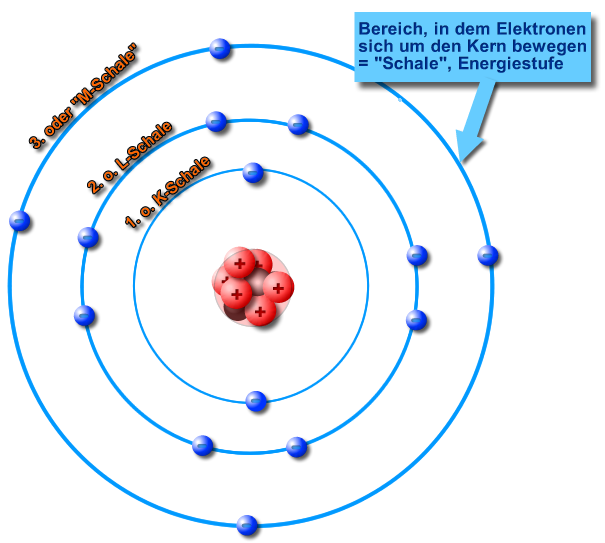
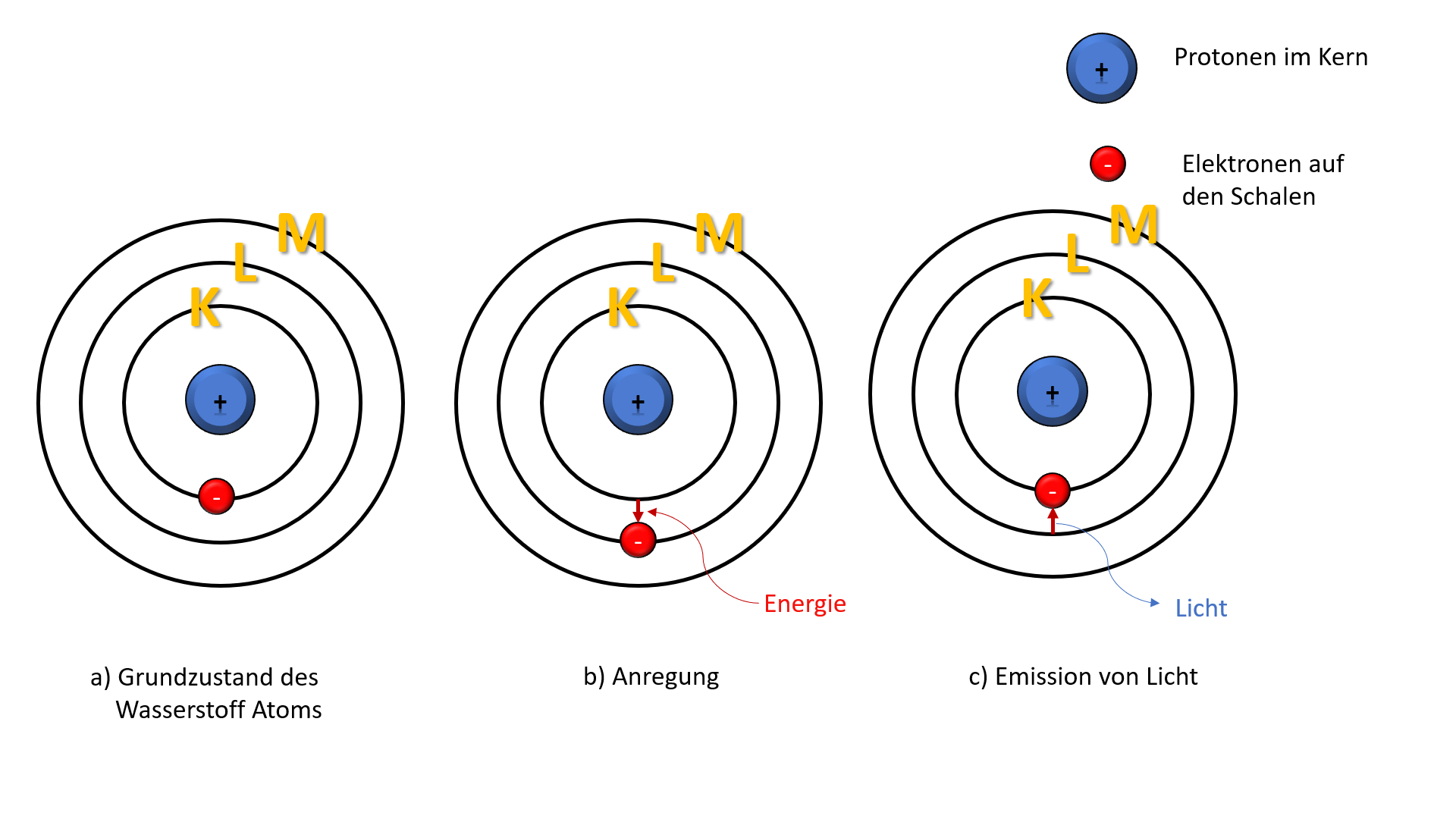
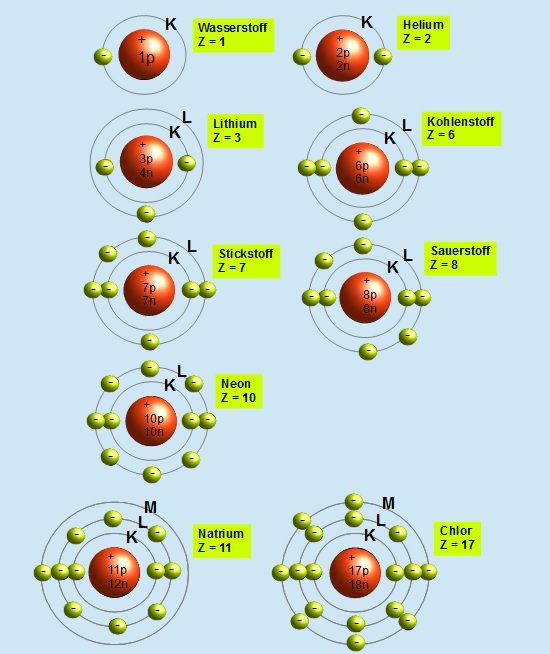
Stellen Sie sich vor, ein Atom ist wie eine kleine, winzige Stadt. Im Zentrum liegt das Rathaus, der Atomkern, wo sich die Protonen (die positiven Jungs) und die Neutronen (die neutralen Vermittler) aufhalten. Um dieses Rathaus herum gibt es verschiedene Ringe oder Ebenen – das sind die Elektronenschalen. Auf diesen Schalen rasen die Elektronen (die negativen Energiebündel) um den Kern herum.
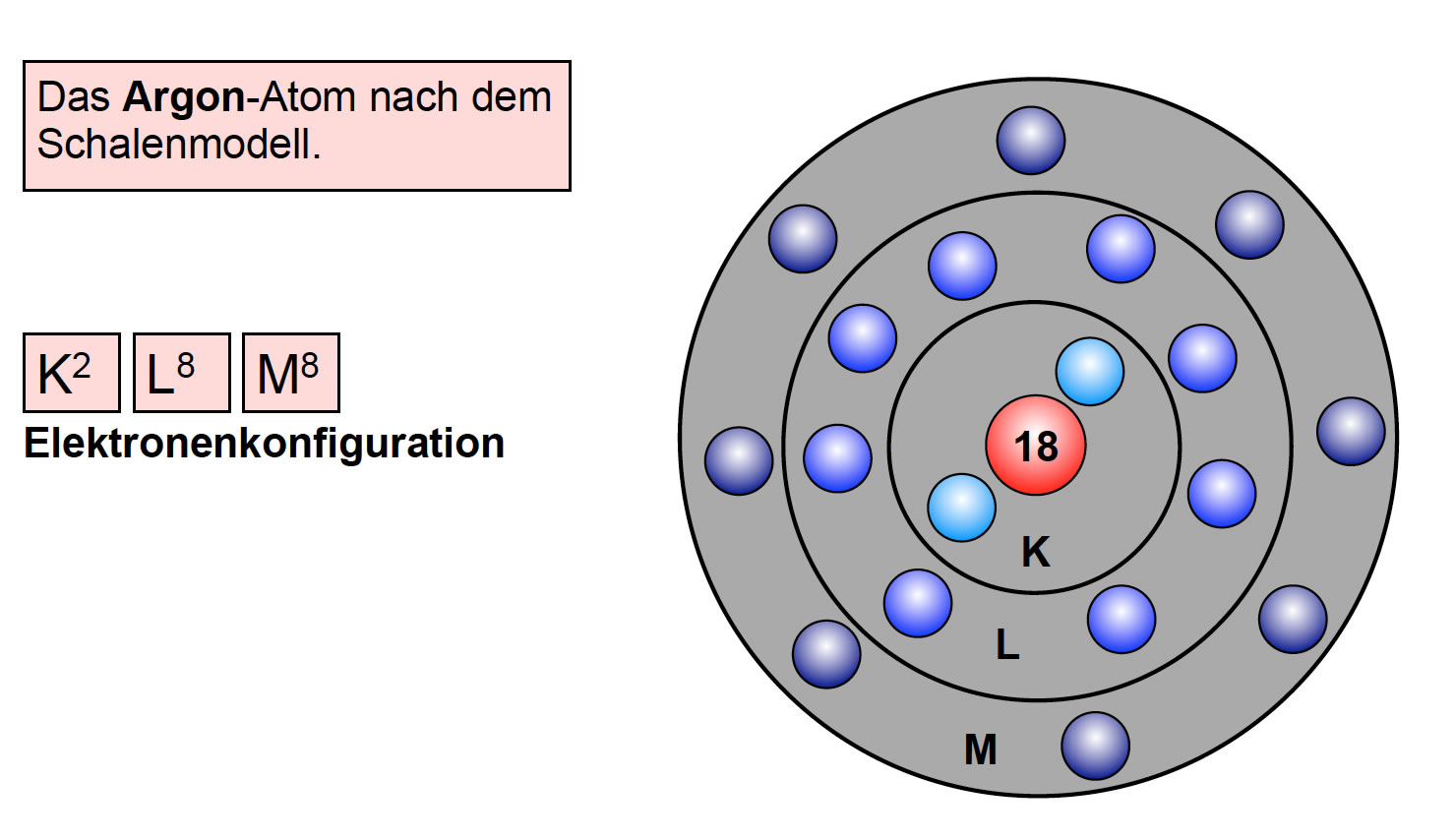
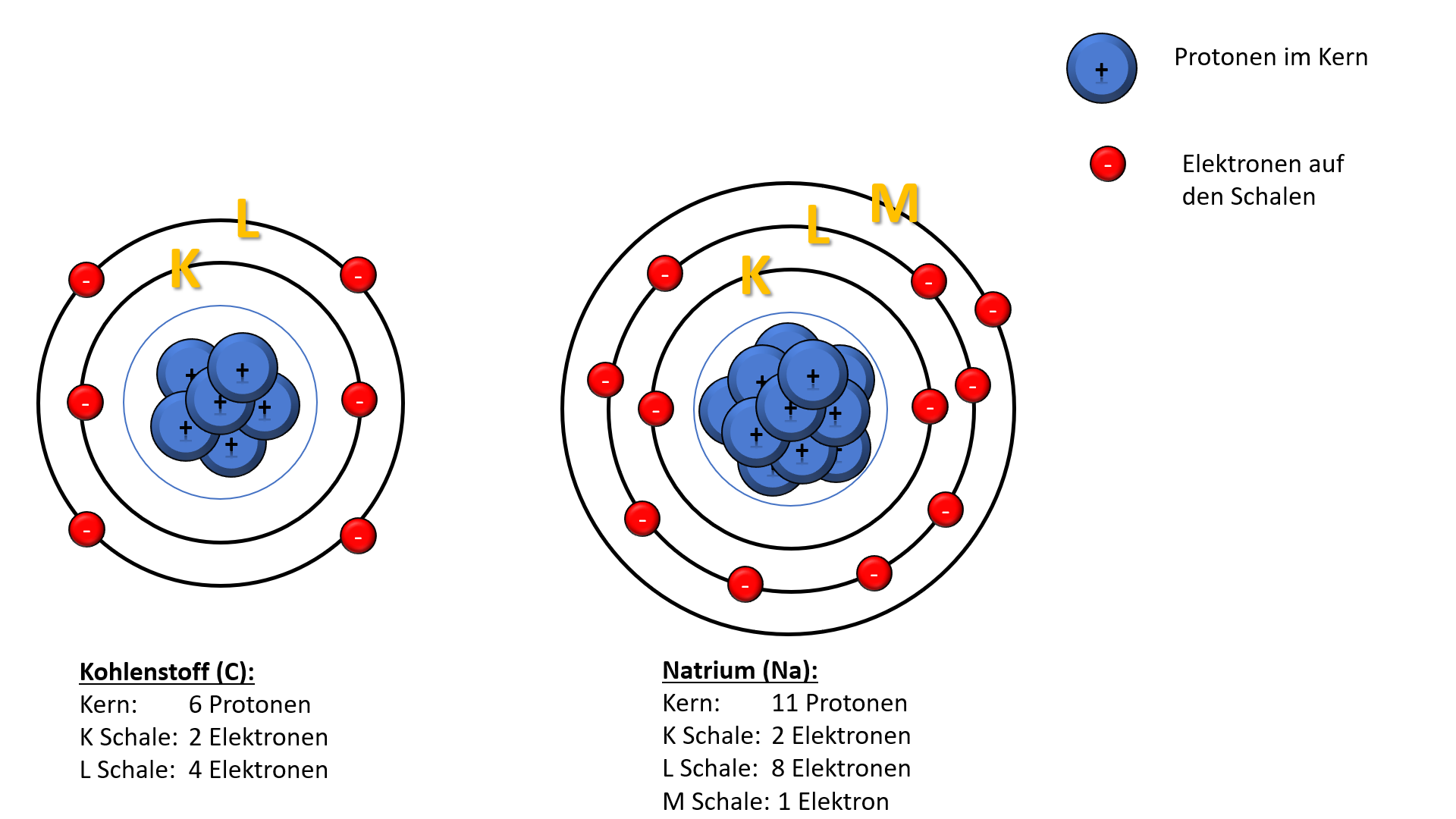
Diese Schalen sind nicht willkürlich angeordnet; sie folgen einer bestimmten Reihenfolge und Kapazität. Die innerste Schale, die K-Schale (n=1), ist die kleinste und kann nur maximal zwei Elektronen aufnehmen. Die nächste Schale, die L-Schale (n=2), kann bis zu acht Elektronen beherbergen, und so weiter. Jede Schale hat eine bestimmte Energiestufe, und die Elektronen füllen die Schalen von innen nach außen auf – also zuerst die K-Schale, dann die L-Schale, usw.
Die Formel hinter der Magie: 2n2
Es gibt eine einfache Formel, um die maximale Anzahl von Elektronen zu bestimmen, die eine Schale aufnehmen kann: 2n2. Hierbei steht 'n' für die Nummer der Schale.
Probieren wir es aus:
- K-Schale (n=1): 2 * 12 = 2 Elektronen
- L-Schale (n=2): 2 * 22 = 8 Elektronen
- M-Schale (n=3): 2 * 32 = 18 Elektronen
- N-Schale (n=4): 2 * 42 = 32 Elektronen
Und jetzt kommen wir zum Star des Tages: die O-Schale (n=5).
Die O-Schale (n=5): Unser heutiger Hauptdarsteller
Die O-Schale ist die fünfte Elektronenschale vom Atomkern aus. Um herauszufinden, wie viele Elektronen dort maximal Platz finden, wenden wir unsere magische Formel an:
2 * 52 = 2 * 25 = 50
Das bedeutet, dass die O-Schale theoretisch bis zu 50 Elektronen aufnehmen kann. Das ist eine ganze Menge!
Warum "theoretisch"?
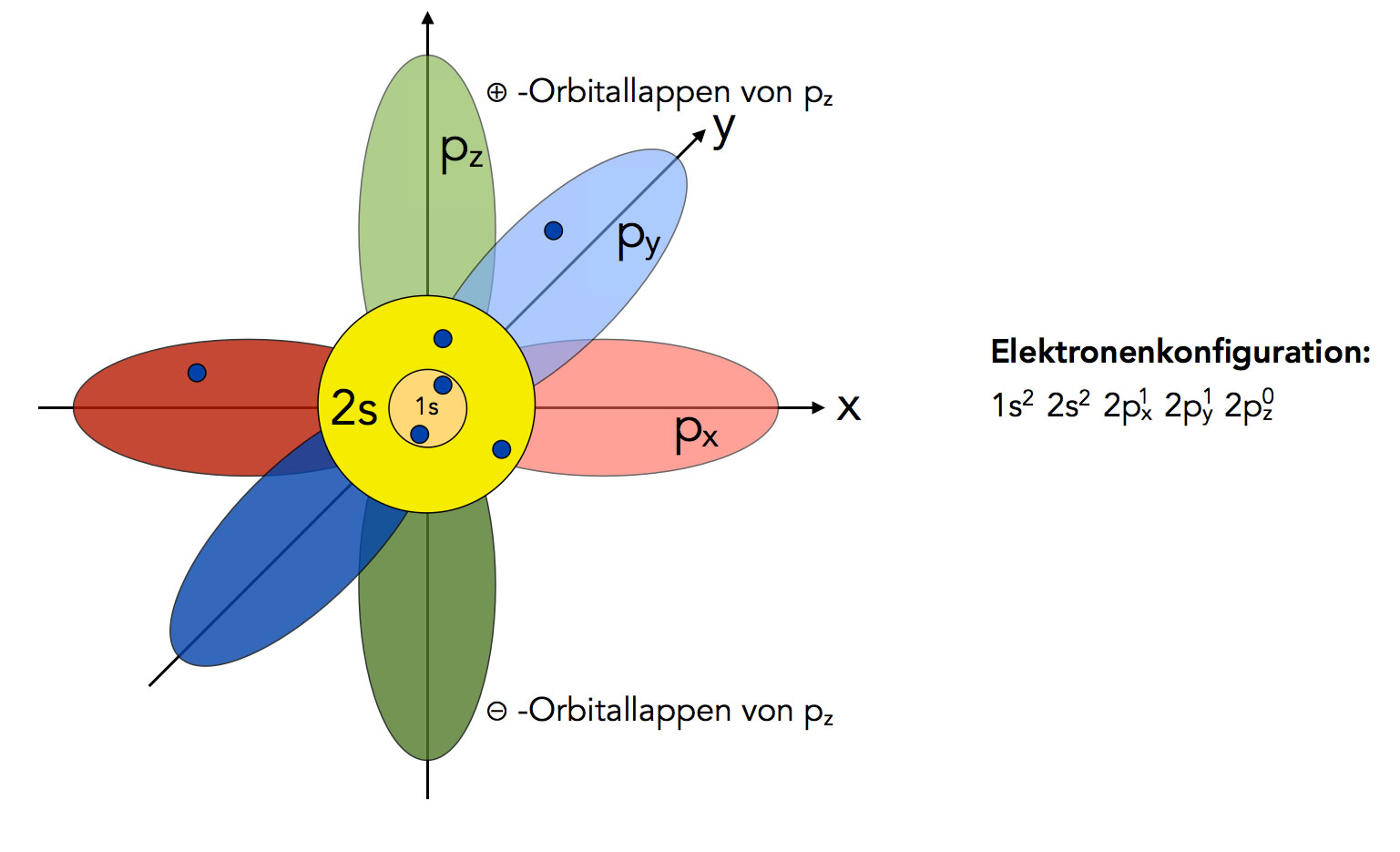
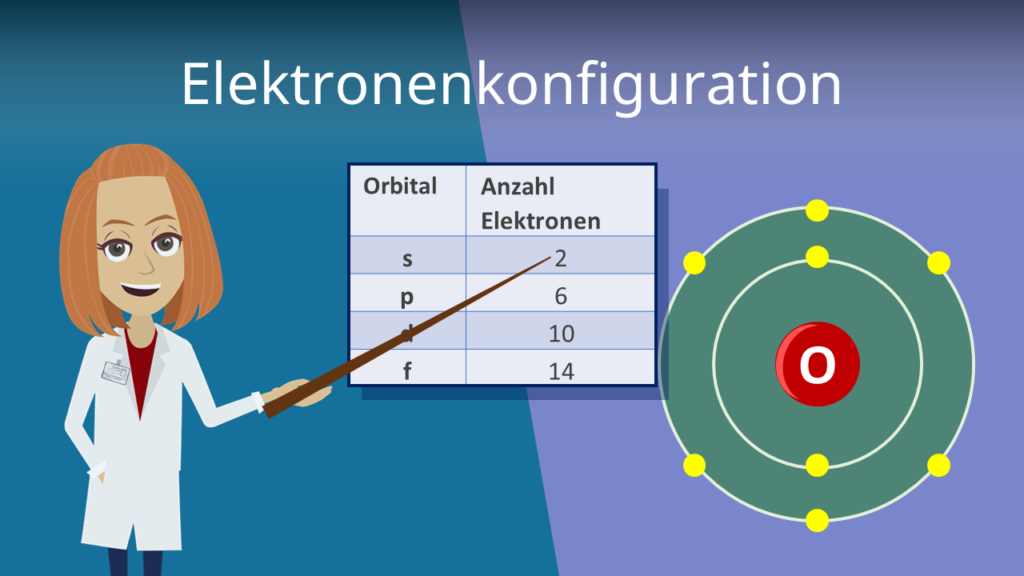
Hier kommt ein kleiner Haken: Auch wenn die Formel 50 Elektronen als Maximum angibt, ist das in der Praxis nicht immer der Fall. Der Grund dafür liegt in den komplexen Wechselwirkungen zwischen den Elektronen und den orbitalen, die sie besetzen. Die O-Schale unterteilt sich in Unterschalen (s, p, d, f, und g Orbitale), und die Art und Weise, wie diese Unterschalen gefüllt werden, folgt bestimmten Regeln, die als Hundsche Regeln und das Pauli-Prinzip bekannt sind.
Diese Regeln besagen, dass Elektronen sich so anordnen, dass sie die niedrigstmögliche Energie erreichen und die Abstoßung zwischen ihnen minimieren. Das führt dazu, dass die O-Schale nicht einfach bis zum Maximum gefüllt wird, bevor die nächste Schale beginnt. Stattdessen füllen sich die Unterschalen in einer etwas komplexeren Reihenfolge, die von der Energie der einzelnen Orbitale abhängt.
In der 5. Periode des Periodensystems (wo die Elemente mit Elektronen in der 5. Schale beginnen) sehen wir, dass die O-Schale nach und nach gefüllt wird. Allerdings kommt es oft vor, dass die Außenschale (die Valenzschale) bereits mit Elektronen gefüllt wird, bevor die O-Schale vollständig mit 50 Elektronen besetzt ist. Denken Sie zum Beispiel an Caesium (Cs), das ein Alkalimetall mit nur einem Elektron in seiner äußersten Schale (der P-Schale) ist, obwohl die O-Schale noch nicht voll ist.
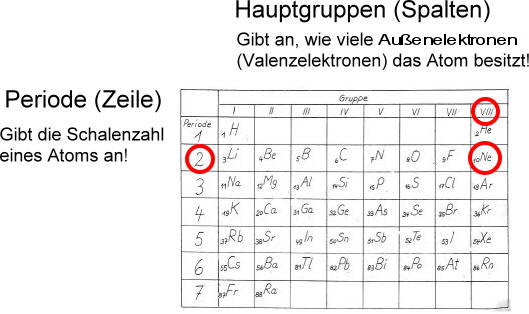
Das Periodensystem: Eine nützliche Landkarte
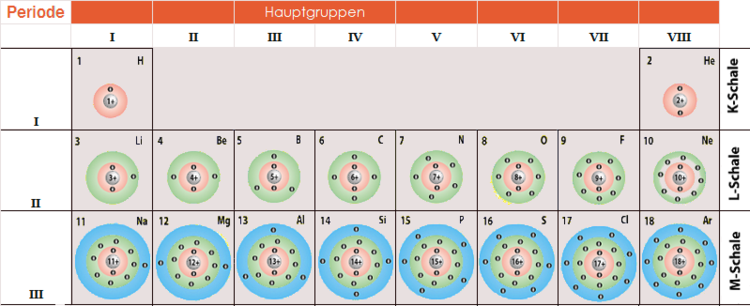
Das Periodensystem der Elemente ist wie eine Landkarte, die uns hilft, die Verteilung der Elektronen in den verschiedenen Schalen zu verstehen. Die Elemente sind nach ihrer Atomnummer geordnet (der Anzahl der Protonen im Kern), und die Anordnung der Elemente spiegelt die Füllung der Elektronenschalen wider.
Jede Periode (waagerechte Reihe) entspricht dem Beginn der Füllung einer neuen Elektronenschale. Die Elemente in der fünften Periode (Rubidium bis Xenon) sind besonders interessant, wenn es um die O-Schale geht, da bei ihnen diese Schale mit Elektronen gefüllt wird.
Wenn Sie sich also fragen, wie viele Elektronen ein bestimmtes Element in der 5. Schale hat, werfen Sie einen Blick auf das Periodensystem und suchen Sie nach dem Element in der fünften Periode. Die Position des Elements im Periodensystem gibt Ihnen einen Hinweis auf die Anzahl der Elektronen in seiner Valenzschale (der äußersten Schale) und indirekt auch auf die Füllung der darunterliegenden O-Schale.
Warum ist das wichtig?
Sie fragen sich vielleicht: "Warum sollte ich das alles wissen, wenn ich nur ein paar Tage in München verbringe?" Nun, auch wenn es nicht direkt Ihr nächstes Weißwurstfrühstück beeinflusst, ist das Verständnis der Elektronenschalen fundamental für das Verständnis der Chemie. Und die Chemie ist überall – in der Luft, die wir atmen, im Wasser, das wir trinken, und in den Materialien, aus denen unsere Häuser gebaut sind.
Das Wissen über die Elektronenschalen hilft uns, die Eigenschaften der Elemente zu verstehen, wie sie miteinander reagieren und welche Verbindungen sie bilden. Es ist die Grundlage für die Entwicklung neuer Materialien, Medikamente und Technologien. Und wer weiß, vielleicht inspiriert Sie dieses Wissen sogar dazu, selbst ein wenig zu forschen oder sich für ein naturwissenschaftliches Studium zu entscheiden!
Fazit: 50 ist die magische Zahl (aber mit Sternchen!)
Zusammenfassend lässt sich sagen: Die O-Schale (die 5. Elektronenschale) kann theoretisch maximal 50 Elektronen aufnehmen. In der Realität wird diese Zahl jedoch aufgrund der komplexen Wechselwirkungen zwischen den Elektronen und den orbitalen nicht immer erreicht. Das Periodensystem ist ein nützliches Werkzeug, um die Verteilung der Elektronen in den verschiedenen Schalen zu verstehen und die Eigenschaften der Elemente vorherzusagen.
Ich hoffe, dieser kleine Ausflug in die Welt der Elektronenschalen hat Ihnen gefallen! Vielleicht haben Sie ja jetzt ein bisschen mehr Hintergrundwissen, um die Welt um sich herum zu verstehen. Und wer weiß, vielleicht sehen Sie die Chemie jetzt mit ganz anderen Augen – nicht mehr als trockenes Schulwissen, sondern als faszinierende Wissenschaft, die das Fundament unserer Welt bildet.
Bis zum nächsten Mal und viel Spaß beim Entdecken!
![Wie Viele Elektronen Passen In Die 5 Schale Schalenmodell • Aufbau und Elektronenschalen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/03/WP_Schalenmodell_Schalenmodell-Alkalimetalle-1024x576.jpg)

![Wie Viele Elektronen Passen In Die 5 Schale Schalenmodell • Aufbau und Elektronenschalen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/03/WP_Schalenmodell_6_schalen-1024x576.jpg)
![Wie Viele Elektronen Passen In Die 5 Schale Schalenmodell • Aufbau und Elektronenschalen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/03/WP_Schalenmodell_1_sauerstoff-1-1024x576.jpg)