Wie Viele Elektronen Passen In Die Schalen
Hallo liebe Freunde, Abenteurer und Wissensdurstige! Stell dir vor, wir sind auf einer faszinierenden Reise, nicht zu fernen Ländern, sondern in die winzige, unsichtbare Welt der Atome. Klingt verrückt? Keine Sorge, ich verspreche, es wird spannend! Heute geht es darum, eine Frage zu beantworten, die vielleicht schon mal in deinem Chemieunterricht aufgetaucht ist: Wie viele Elektronen passen eigentlich in die Schalen eines Atoms?
Ich erinnere mich noch gut an meine Schulzeit. Chemie war nie so ganz mein Freund. All diese Formeln und Theorien... puh! Aber eines hat mich immer fasziniert: Das Bild vom Atom mit seinen Elektronen, die wie kleine Planeten um einen Kern kreisen. Natürlich ist dieses Bild vereinfacht, aber es hilft, das Konzept zu verstehen.
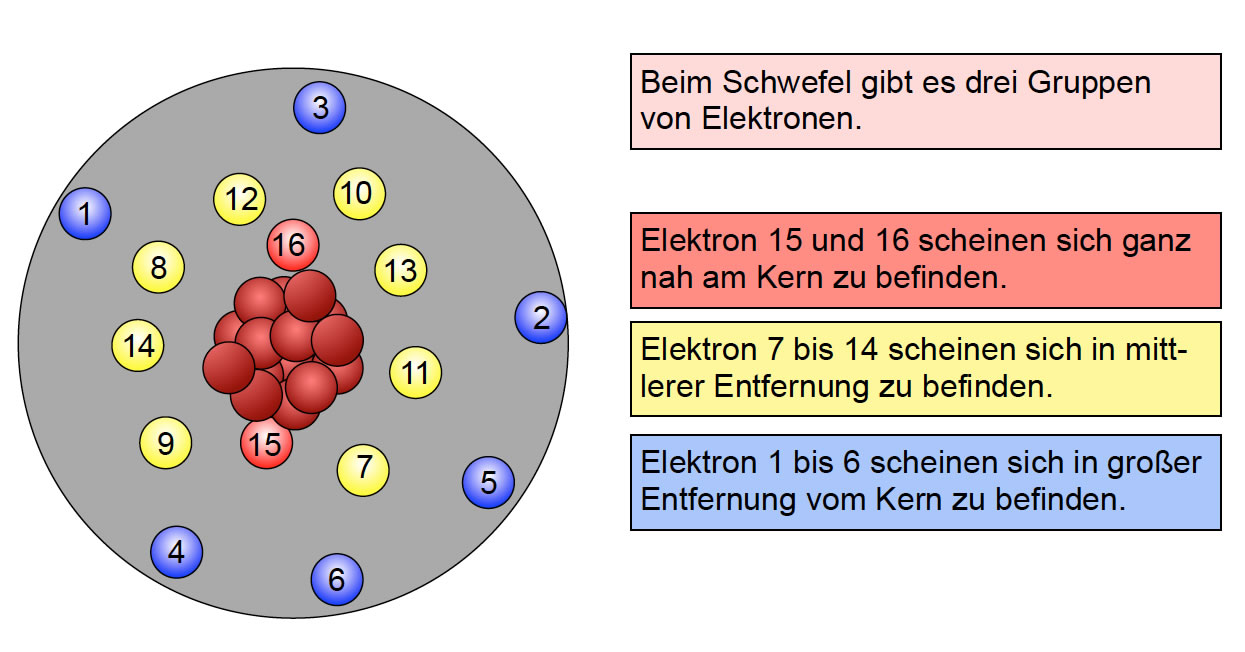
Stell dir vor, das Atom ist wie ein riesiges, mehrstöckiges Hotel. Der Atomkern, der aus Protonen und Neutronen besteht, ist die Basis des Hotels. Und die verschiedenen "Stockwerke" um den Kern herum, das sind die Elektronenschalen. Jede dieser Schalen kann nur eine bestimmte Anzahl von Elektronen "beherbergen". Warum? Nun, das hat mit den Gesetzen der Quantenmechanik zu tun. Klingt kompliziert? Ist es auch ein bisschen, aber wir werden es vereinfachen!
Die K-Schale: Die Erste und Kleinste
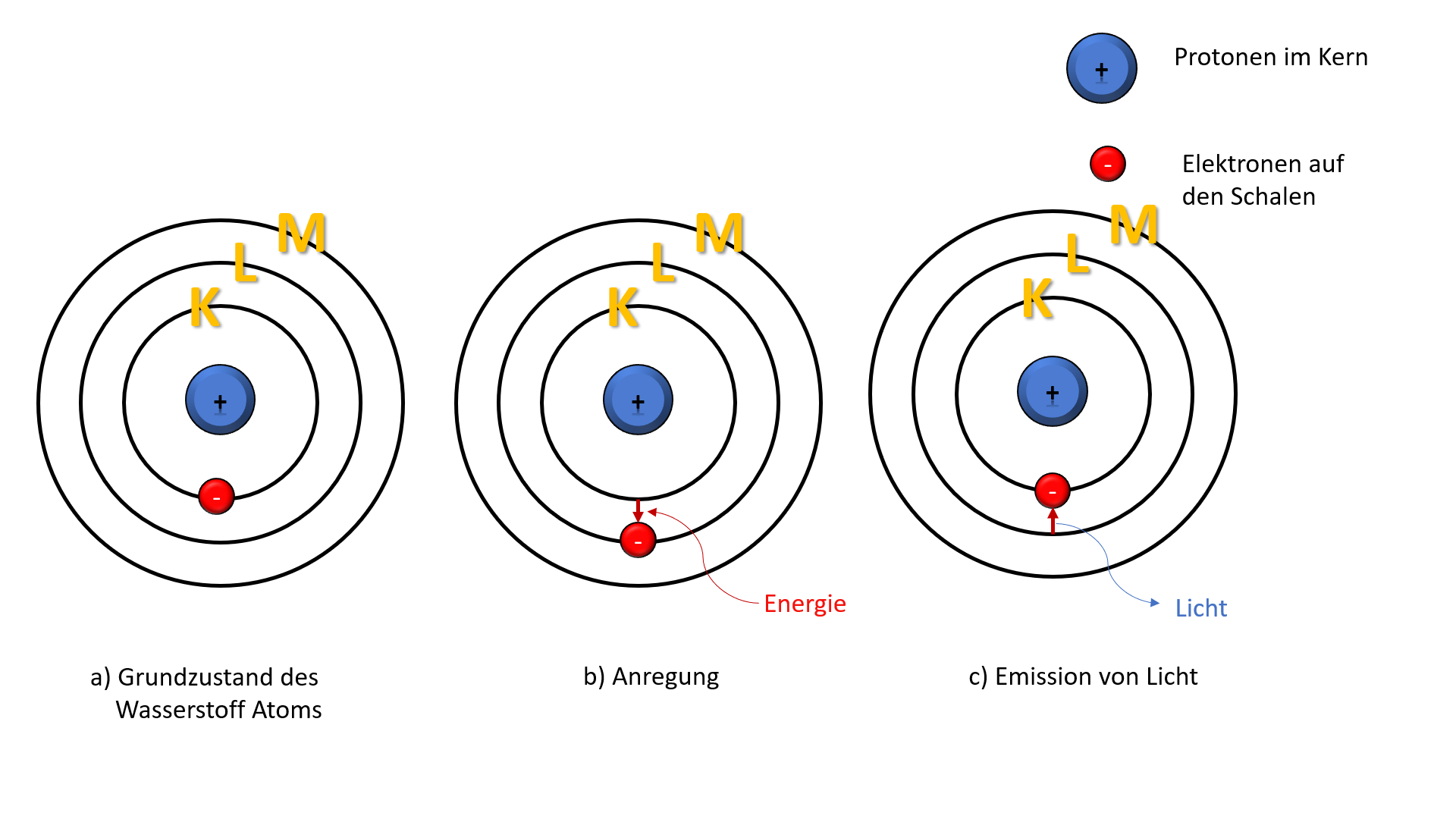
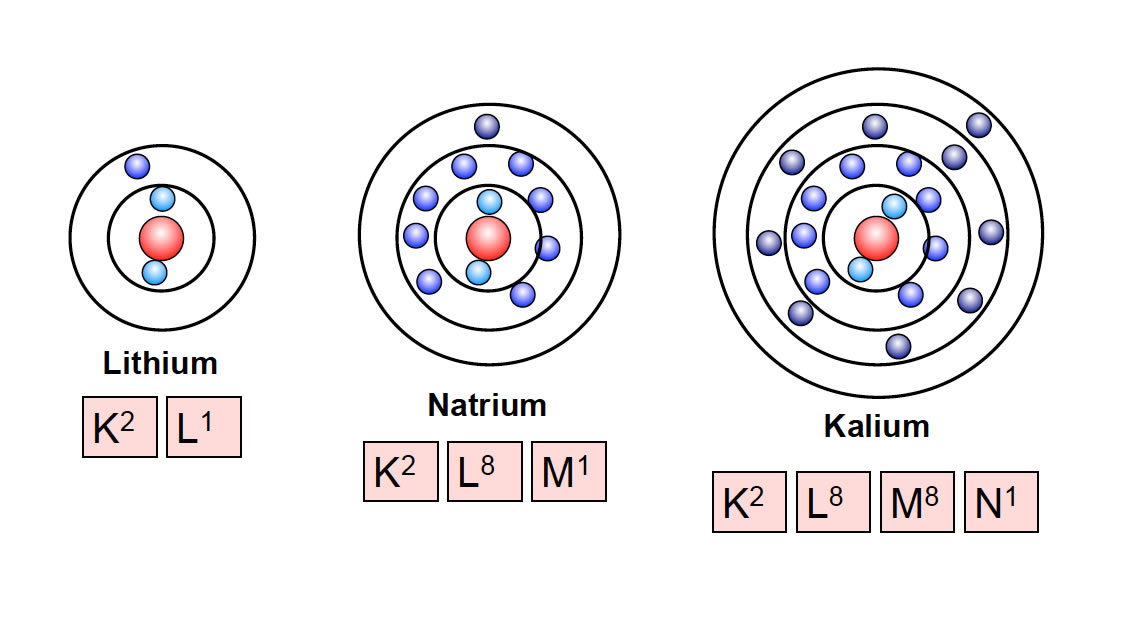
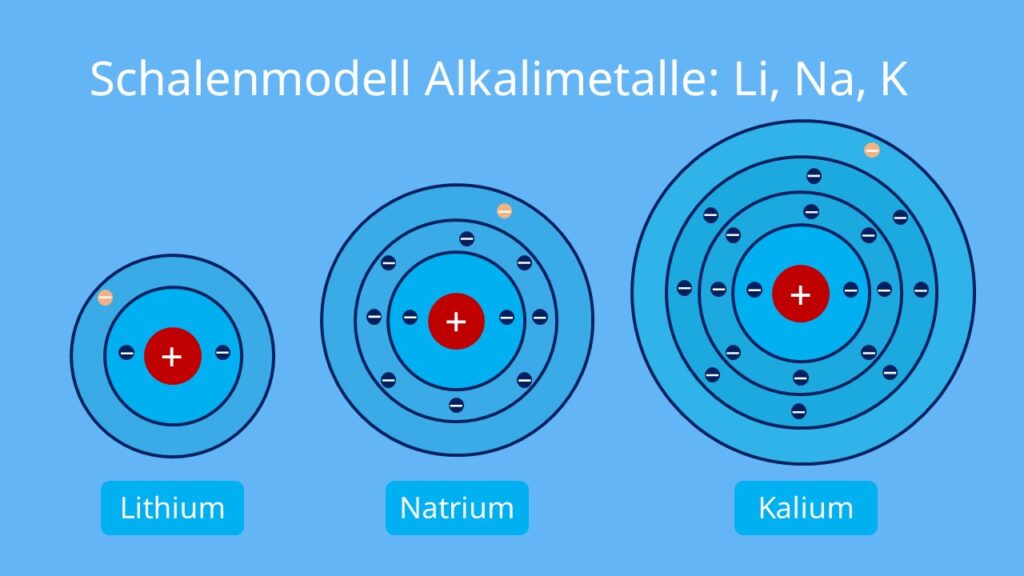
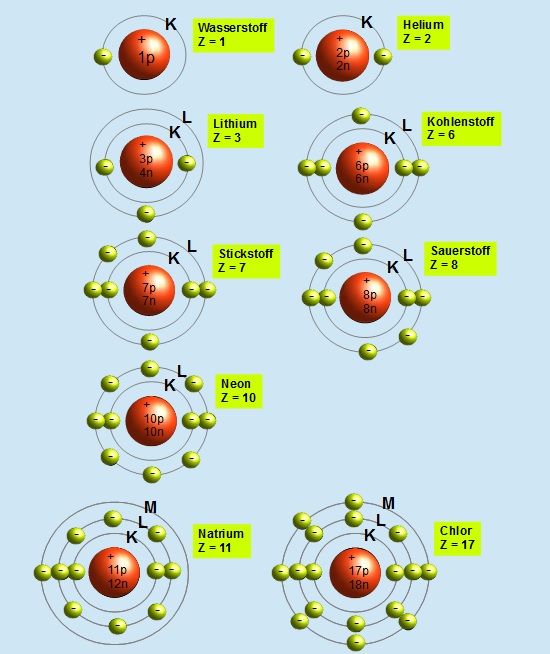
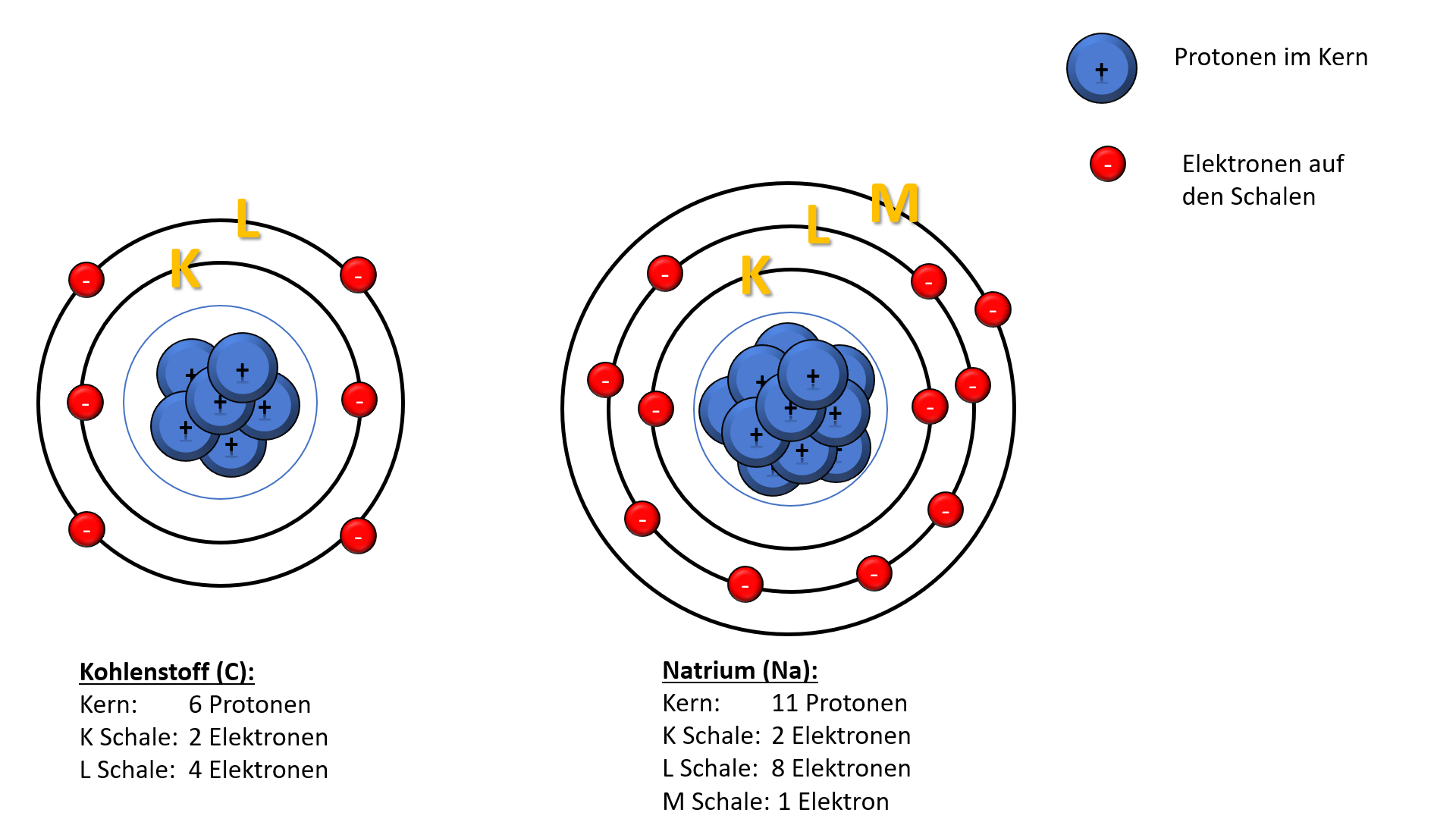
Die erste Schale, die K-Schale, ist dem Atomkern am nächsten. Sie ist sozusagen die Suite im Erdgeschoss, klein, aber fein. Und wie viele Elektronen passen hier hinein? Nur zwei! Ja, du hast richtig gelesen. Mehr geht nicht. Wenn die K-Schale voll ist, müssen die nächsten Elektronen in die nächste Schale "einchecken".
Denk daran, wie wenn du in einem kleinen, gemütlichen Zelt campierst. Mehr als zwei Personen passen da einfach nicht rein, ohne dass es ungemütlich wird. Genauso ist es mit der K-Schale. Zwei Elektronen, und dann ist Schluss mit der Gemütlichkeit.
Die L-Schale: Mehr Platz für Reisende
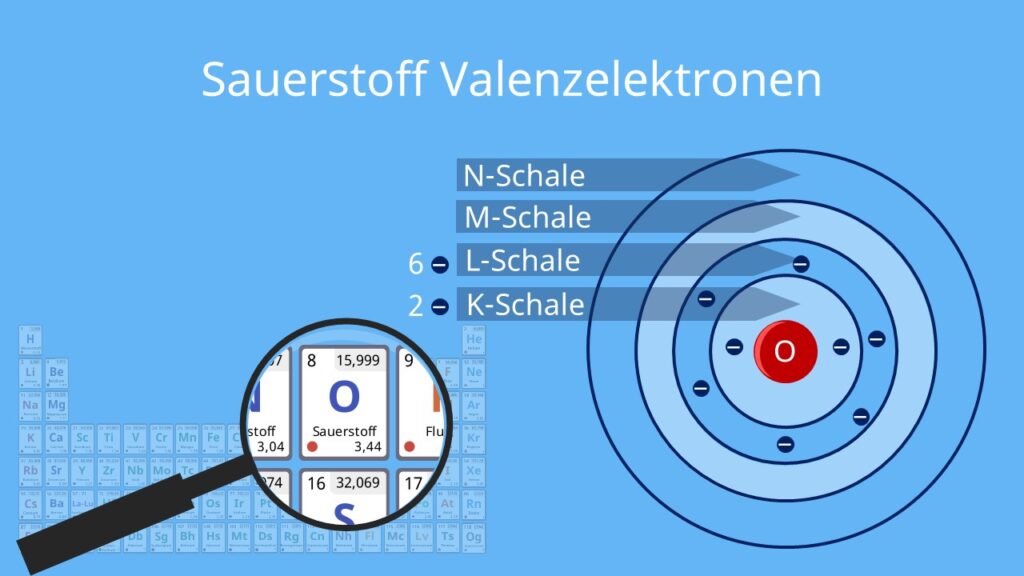
Die nächste Schale, die L-Schale, ist schon deutlich geräumiger. Hier können schon mehr Elektronen untergebracht werden. Um genau zu sein: Acht Elektronen! Stell dir vor, die L-Schale ist wie ein geräumiges Apartment mit mehreren Zimmern. Hier können sich die Elektronen schon etwas freier bewegen und sind nicht so beengt wie in der K-Schale.
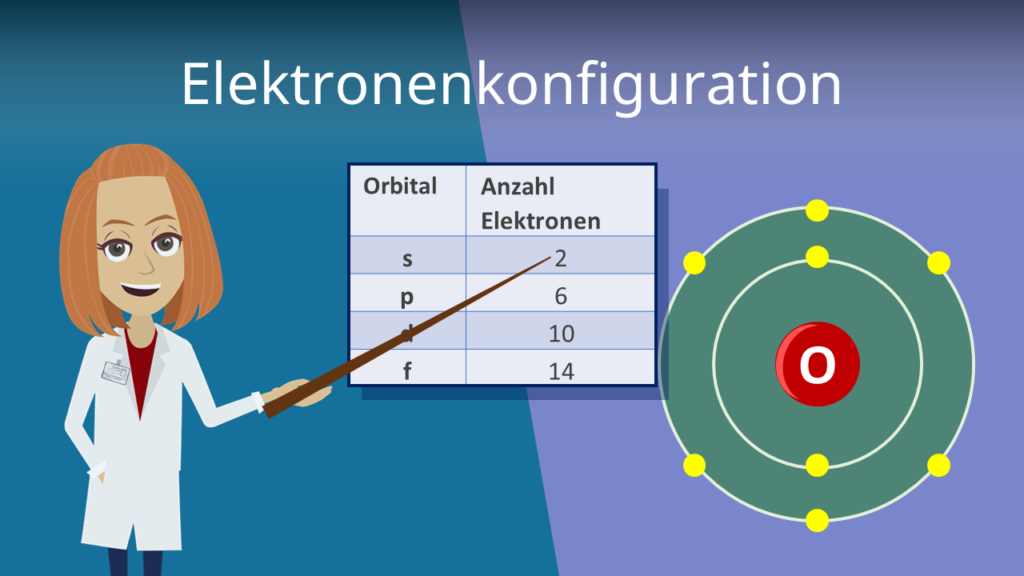
Warum gerade acht? Das hängt mit den sogenannten Orbitalen zusammen. Jede Schale besteht aus verschiedenen Orbitalen, und jedes Orbital kann maximal zwei Elektronen aufnehmen. Die L-Schale hat vier Orbitale, also 4 x 2 = 8 Elektronen. Klingt kompliziert? Ja, aber das ist die Kurzfassung!
Es ist wie bei einer Jugendherberge: Es gibt Mehrbettzimmer, und in jedem Zimmer haben zwei Reisende Platz. In der L-Schale gibt es vier solcher Zimmer, also insgesamt Platz für acht Reisende – äh, Elektronen!
Die M-Schale: Eine Großfamilie zieht ein
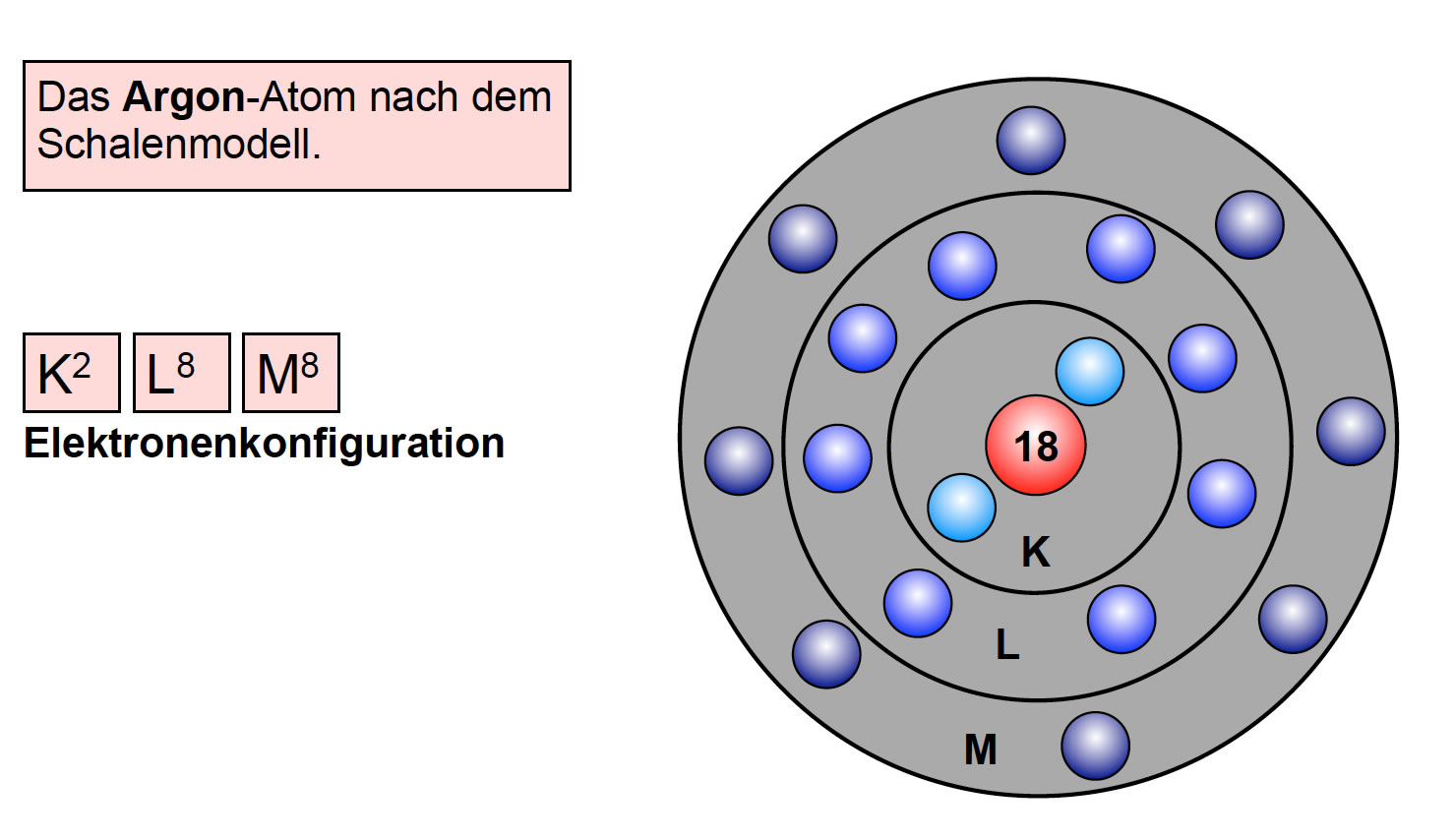
Die M-Schale ist schon richtig groß! Hier passen sage und schreibe achtzehn Elektronen hinein! Stell dir vor, die M-Schale ist wie ein riesiges Schloss mit vielen Zimmern und Sälen. Hier können sich die Elektronen so richtig austoben.
Aber Achtung! Obwohl die M-Schale Platz für 18 Elektronen bietet, füllt sie sich nicht immer vollständig, bevor die nächste Schale, die N-Schale, besetzt wird. Das liegt an den komplexen Energieverhältnissen innerhalb des Atoms. In manchen Fällen ist es energetisch günstiger, zuerst ein oder zwei Elektronen in die N-Schale zu geben, bevor die M-Schale vollständig gefüllt ist. Das nennt man die Edelgasregel oder Oktettregel.
Es ist wie bei einem Umzug in ein neues Haus: Manchmal stellt man zuerst die wichtigsten Möbel in die Schlafzimmer, bevor man den Rest des Hauses einrichtet. Genauso ist es mit den Elektronen und den Schalen.
Die N-Schale und darüber hinaus: Unendliche Weiten
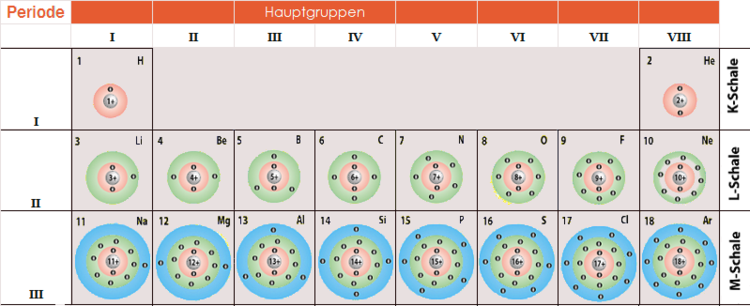
Nach der M-Schale kommen noch die N-Schale, die O-Schale, die P-Schale und so weiter. Jede dieser Schalen kann noch mehr Elektronen aufnehmen. Die Formel dafür lautet: 2n2, wobei n die Nummer der Schale ist. Für die N-Schale (n=4) ergibt das 2 x 42 = 32 Elektronen! Unglaublich, oder?
Allerdings werden diese Schalen in den meisten "normalen" Atomen nicht vollständig gefüllt. Das liegt daran, dass die Atome mit den vollsten Schalen in der Regel sehr instabil wären. Atome "streben" nach einer möglichst stabilen Konfiguration, und das bedeutet oft, dass die äußere Schale (die Valenzschale) entweder voll oder halb voll ist. Das erklärt, warum die Edelgase so reaktionsträge sind: Ihre Valenzschale ist bereits vollständig gefüllt.
Stell dir vor, du bist auf einer Weltreise und besuchst immer größere und luxuriösere Hotels. Aber irgendwann reicht es auch. Du suchst dir einen gemütlichen Ort, an dem du dich wohlfühlst und zur Ruhe kommen kannst. Genauso ist es mit den Atomen und ihren Elektronen.
Die Bedeutung für die Chemie
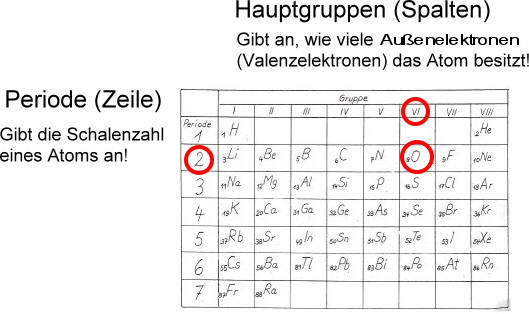
Warum ist das alles wichtig? Weil die Anzahl der Elektronen in den verschiedenen Schalen, insbesondere in der Valenzschale (der äußersten Schale), die chemischen Eigenschaften eines Atoms bestimmt. Atome mit der gleichen Anzahl von Valenzelektronen haben ähnliche chemische Eigenschaften. Das erklärt, warum die Elemente in der gleichen Gruppe im Periodensystem ähnliche Eigenschaften aufweisen.
Die Elektronenkonfiguration bestimmt, ob ein Atom gerne Bindungen mit anderen Atomen eingeht, ob es reaktiv ist oder eben nicht. Es ist wie beim Dating: Die Elektronen sind wie die Persönlichkeiten der Atome, und je nachdem, wie sie "gestrickt" sind, passen sie gut zusammen oder eben nicht.
"Die Chemie ist die Lehre von den Elektronen, ihren Bindungen und ihren Reaktionen." - Ein kluger Chemiker (vermutlich)
Also, das war unsere kleine Reise in die Welt der Atome und ihrer Elektronenschalen. Ich hoffe, du hast etwas gelernt und hattest dabei auch noch Spaß. Denk daran: Chemie muss nicht langweilig sein! Sie ist überall um uns herum, in allem, was wir sehen und anfassen können.
Wenn du das nächste Mal eine Kerze anzündest, denke daran, dass die Flamme das Ergebnis einer chemischen Reaktion ist, bei der Elektronen zwischen Atomen ausgetauscht werden. Und wenn du ein Glas Wasser trinkst, denke daran, dass das Wasser aus Molekülen besteht, die durch die Anziehungskraft zwischen Elektronen zusammengehalten werden. Die Welt der Atome ist faszinierend, und es gibt noch so viel zu entdecken!
Bis zum nächsten Abenteuer, und bleibt neugierig!
![Wie Viele Elektronen Passen In Die Schalen Schalenmodell • Aufbau und Elektronenschalen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/03/WP_Schalenmodell_1_sauerstoff-1-1024x576.jpg)
![Wie Viele Elektronen Passen In Die Schalen Schalenmodell • Aufbau und Elektronenschalen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/03/WP_Schalenmodell_4_halogene-2-1024x576.jpg)
![Wie Viele Elektronen Passen In Die Schalen Schalenmodell • Aufbau und Elektronenschalen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/03/WP_Schalenmodell_6_schalen-1024x576.jpg)