Wie Viele Elektronen Pro Schale
Die Frage, wie viele Elektronen in jede Schale eines Atoms passen, ist fundamental für das Verständnis der Chemie und der Eigenschaften der Materie. Diese Frage ist nicht nur von theoretischem Interesse, sondern auch von großer praktischer Bedeutung für die Entwicklung neuer Materialien, Medikamente und Technologien. Einblicke in die Elektronenkonfiguration eines Atoms offenbaren, warum bestimmte Elemente reaktionsfreudiger sind als andere, warum Materialien leitfähig oder isolierend sind und wie Atome miteinander Bindungen eingehen. In diesem Artikel werden wir diese Thematik aus der Perspektive einer Museumsausstellung beleuchten, die sowohl lehrreich als auch für Besucher jeden Alters zugänglich ist.
Die Ausstellung: Eine Reise in die Welt der Elektronen
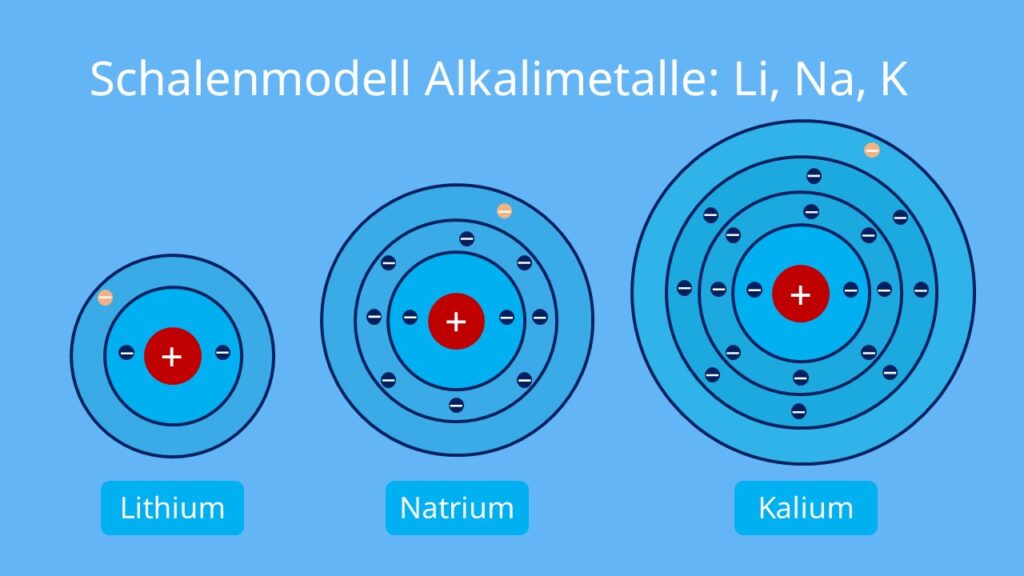
Stellen wir uns eine interaktive Ausstellung vor, die Besucher auf eine Reise durch die faszinierende Welt der Atome und Elektronen mitnimmt. Der erste Bereich widmet sich dem Atommodell selbst. Hier werden verschiedene Modelle vorgestellt – von Daltons einfacher Kugel bis hin zum modernen quantenmechanischen Modell. Besonders hervorgehoben wird die Entwicklung des Schalenmodells nach Bohr und Rutherford, das den Grundstein für unser heutiges Verständnis legte. Interaktive Touchscreens ermöglichen es den Besuchern, die verschiedenen Atommodelle zu erkunden, zu rotieren und zu vergleichen. Ein 3D-Druck eines Goldatoms, das mit maßstabsgetreuen Elektronen in den Schalen versehen ist, vermittelt den Besuchern eine greifbare Vorstellung von der atomaren Struktur.
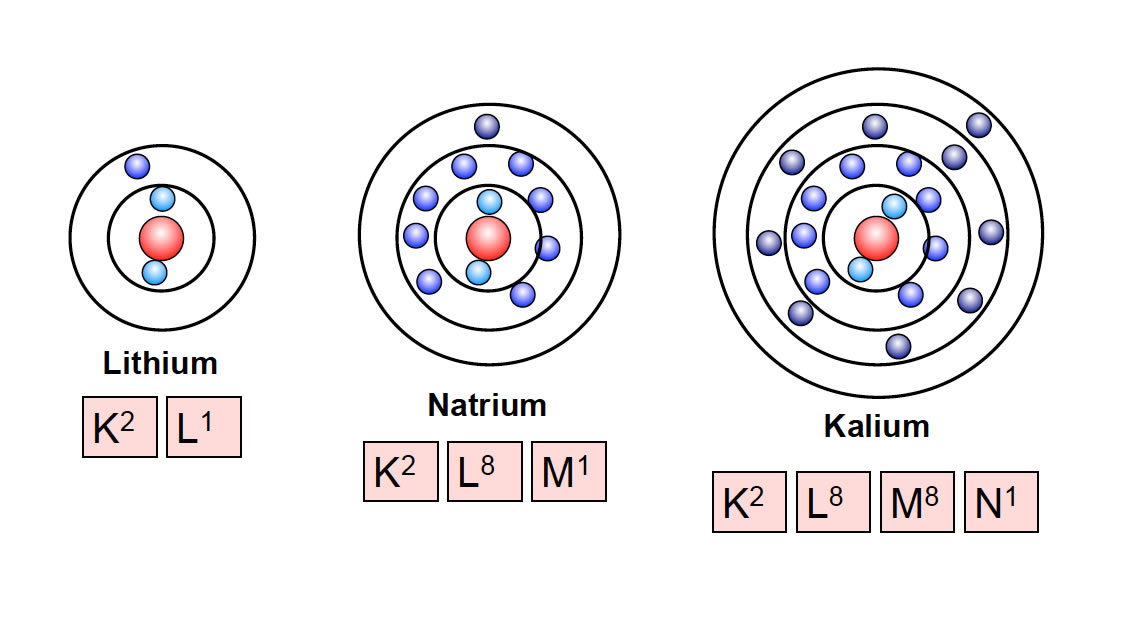
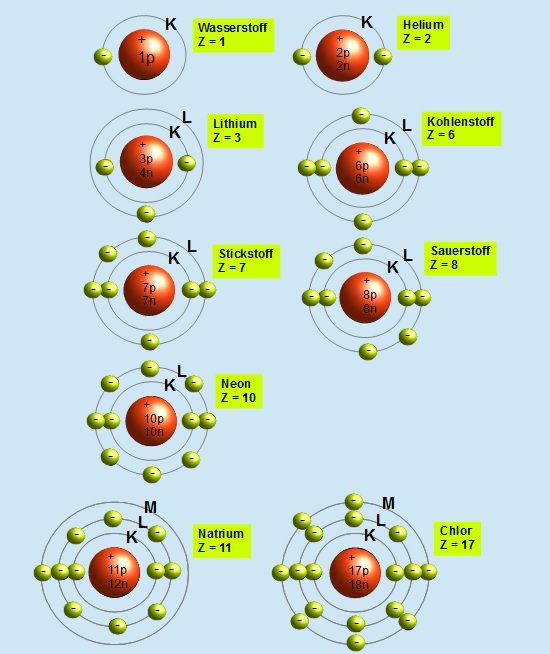
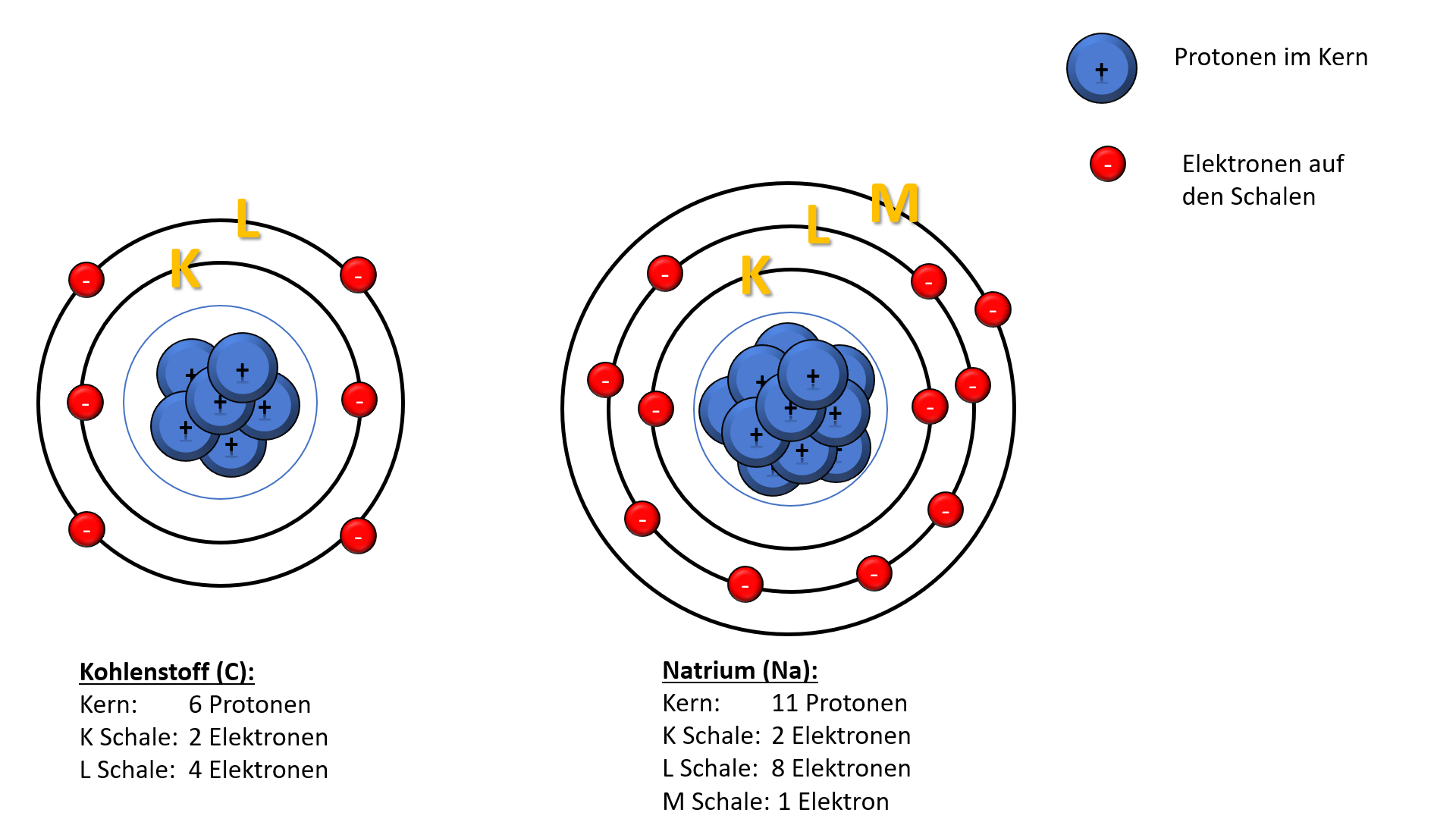
Die K-Schale: Die innerste Schale
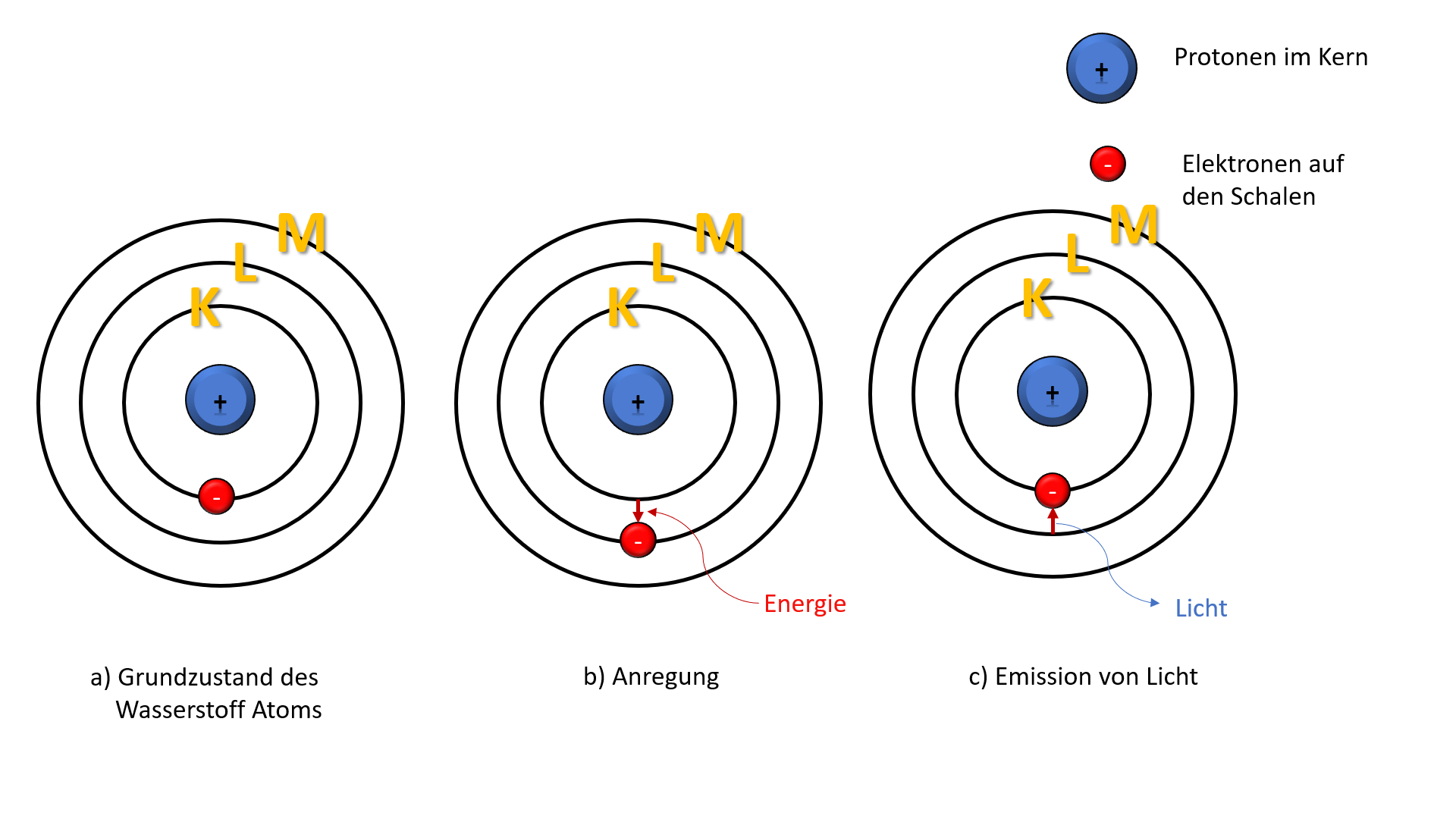
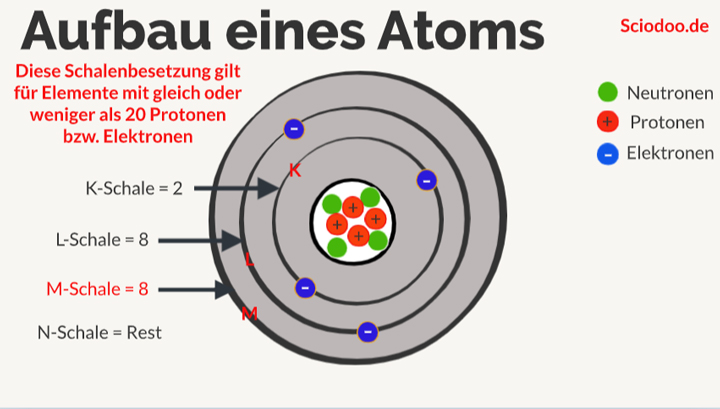
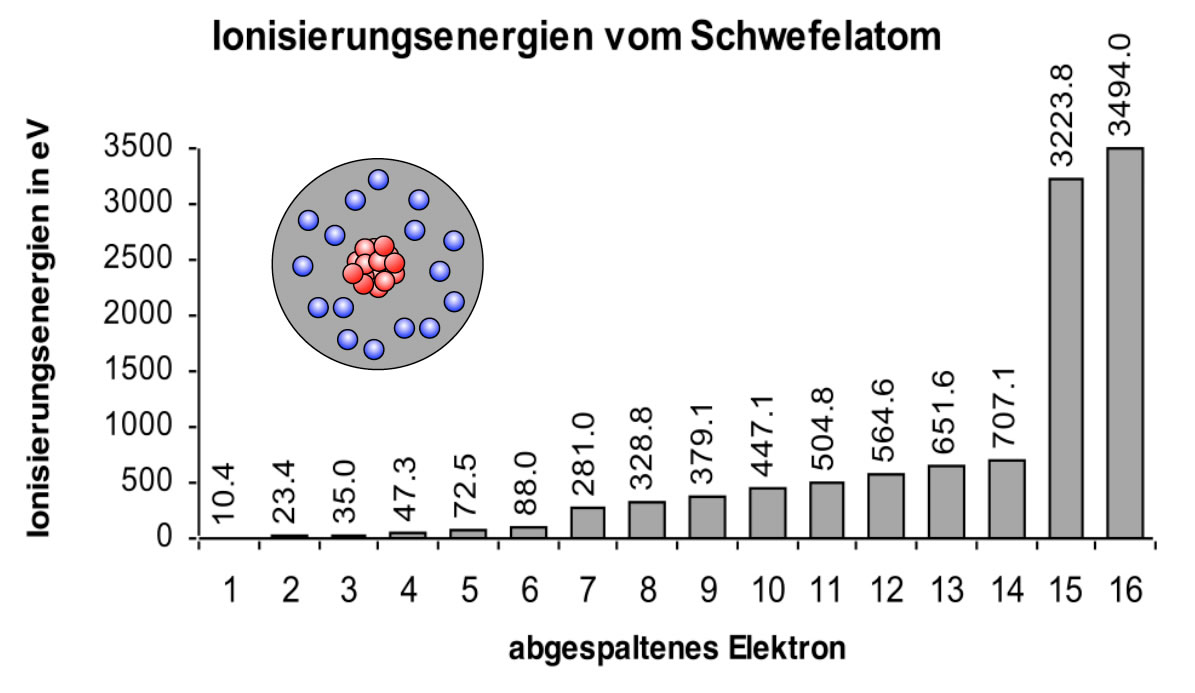
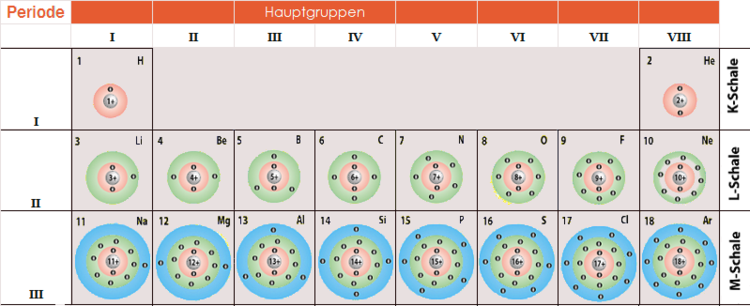
Der nächste Ausstellungsbereich konzentriert sich auf die einzelnen Schalen. Die K-Schale, die dem Atomkern am nächsten liegt, wird als erstes vorgestellt. Die K-Schale, auch n=1 genannt, ist die innerste Schale und kann maximal zwei Elektronen aufnehmen. Die Ausstellung erklärt dies anhand der Quantenzahlen. Die Hauptquantenzahl (n) bestimmt die Energie der Schale, und für n=1 gibt es nur ein Orbital: das 1s-Orbital. Ein Orbital kann maximal zwei Elektronen mit entgegengesetztem Spin aufnehmen. Diese einfache Regel, die sich aus den Prinzipien der Quantenmechanik ergibt, hat tiefgreifende Auswirkungen auf die Eigenschaften der Elemente.
Um die Bedeutung dieser Regel zu veranschaulichen, wird ein interaktives Spiel angeboten: Besucher können virtuelle Elektronen in die K-Schale eines Wasserstoff- und eines Heliumatoms einfügen. Bei Wasserstoff kann ein Elektron hinzugefügt werden, bei Helium sind beide Plätze belegt. Eine rote Lampe signalisiert, wenn versucht wird, ein drittes Elektron in die K-Schale einzufügen, und eine kurze Erklärung des Pauli-Ausschlussprinzips wird eingeblendet. Dieser spielerische Ansatz vermittelt ein grundlegendes Verständnis der Elektronenkonfiguration.
L- und M-Schalen: Eine komplexere Welt
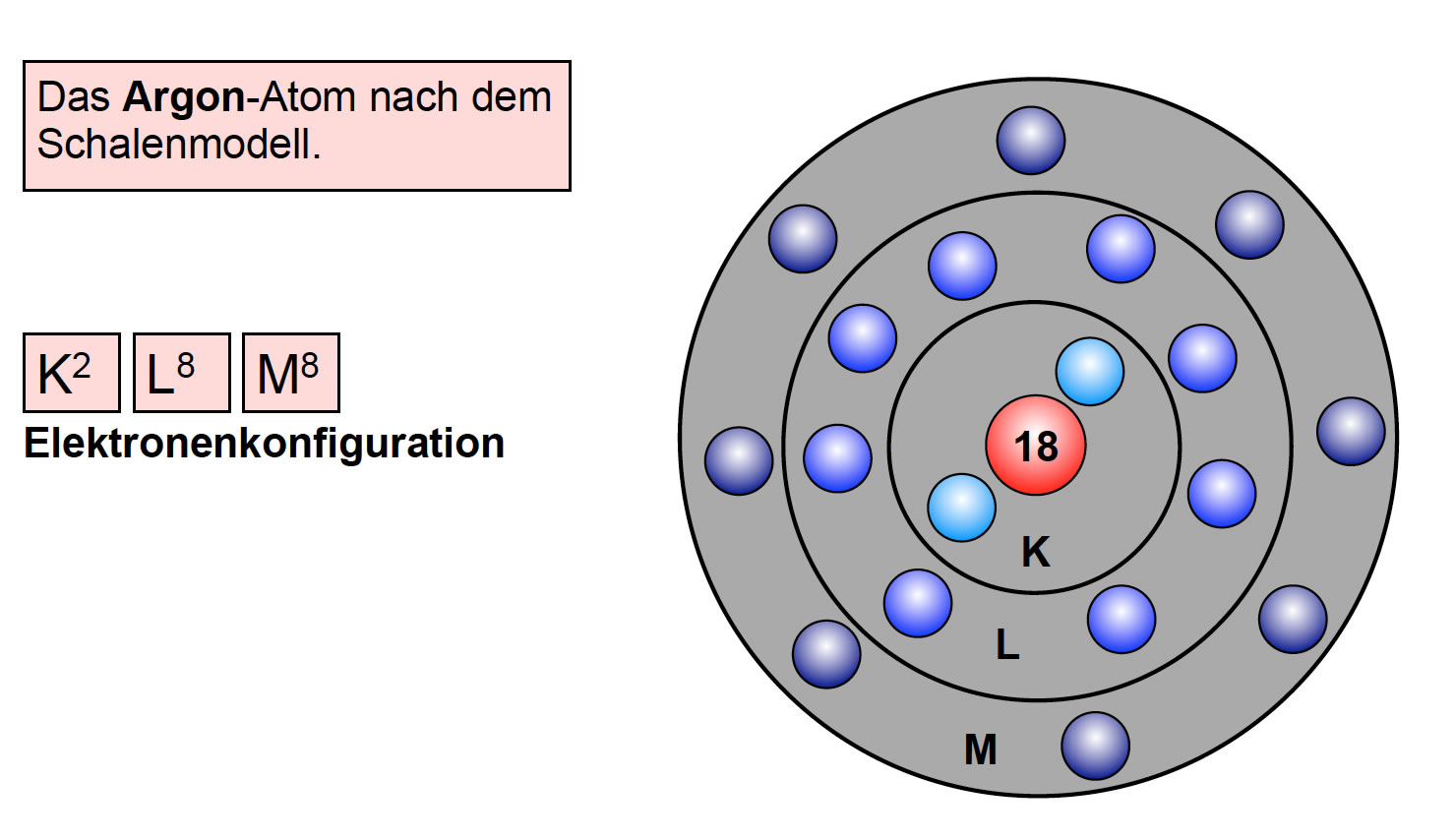
Die Ausstellung schreitet weiter zu den L- und M-Schalen fort (n=2 und n=3). Hier wird es komplexer. Die L-Schale kann maximal acht Elektronen aufnehmen, während die M-Schale bis zu 18 Elektronen aufnehmen kann. Die Erklärung erfolgt wiederum mithilfe der Quantenzahlen. Für n=2 gibt es ein 2s-Orbital und drei 2p-Orbitale, was insgesamt vier Orbitale ergibt. Jedes Orbital kann zwei Elektronen aufnehmen, daher 4 x 2 = 8 Elektronen. Ähnlich verhält es sich mit der M-Schale, die ein 3s-Orbital, drei 3p-Orbitale und fünf 3d-Orbitale enthält, was zu einer maximalen Kapazität von 18 Elektronen führt.
Um die räumliche Anordnung der Orbitale zu visualisieren, werden holographische Projektionen verwendet. Besucher können um die Projektionen herumgehen und die unterschiedlichen Formen der s-, p- und d-Orbitale aus verschiedenen Blickwinkeln betrachten. Eine interaktive Software ermöglicht es den Besuchern, die Orbitale zu "füllen", wobei die Hundsche Regel (erst jedes Orbital einfach besetzen, dann doppelt) berücksichtigt wird. Diese Visualisierung hilft, das abstrakte Konzept der Quantenzahlen und Orbitale greifbar zu machen.
"Das Verständnis der Elektronenkonfiguration ist der Schlüssel zum Verständnis der Chemie." - Zitat einer fiktiven Chemikerin auf einer Ausstellungstafel.
Ein weiterer Ausstellungsbereich widmet sich den Ausnahmen von der Regel. Kupfer und Chrom beispielsweise weisen Elektronenkonfigurationen auf, die von der erwarteten Konfiguration abweichen. Dies liegt daran, dass halb gefüllte und vollständig gefüllte d-Orbitale besonders stabil sind. Die Ausstellung erklärt diese Ausnahmen anhand von Energiebetrachtungen und Orbitaldiagrammen, die die relative Energie der verschiedenen Orbitale veranschaulichen. Ein Quiz fordert die Besucher heraus, die Elektronenkonfiguration verschiedener Elemente vorherzusagen und ihre Antworten mit den tatsächlichen Konfigurationen zu vergleichen.
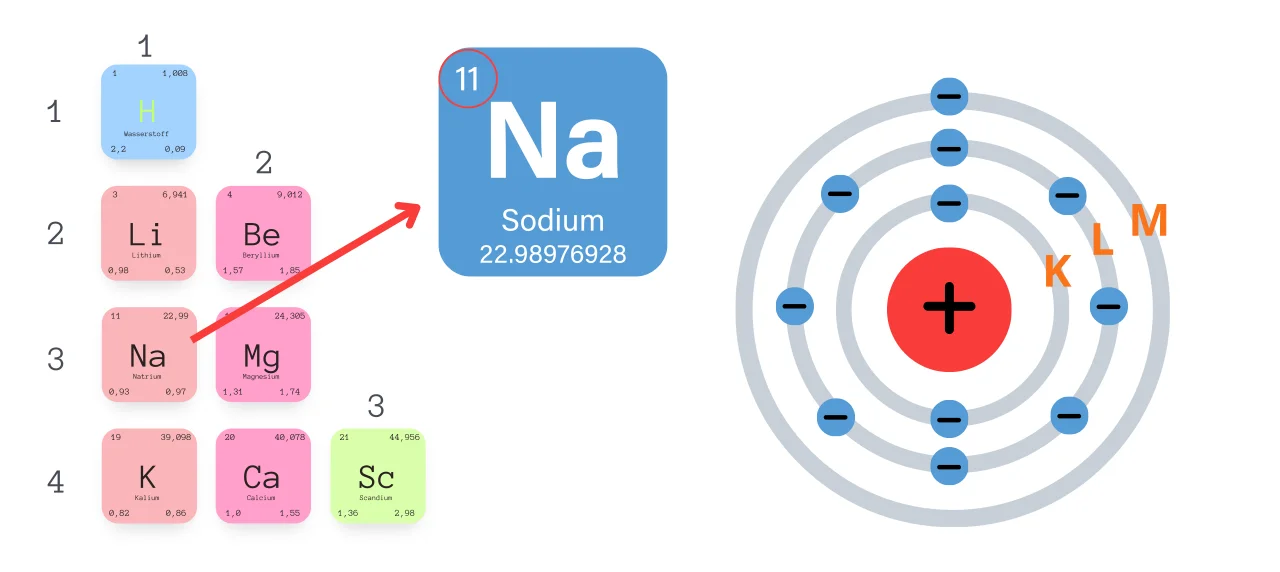
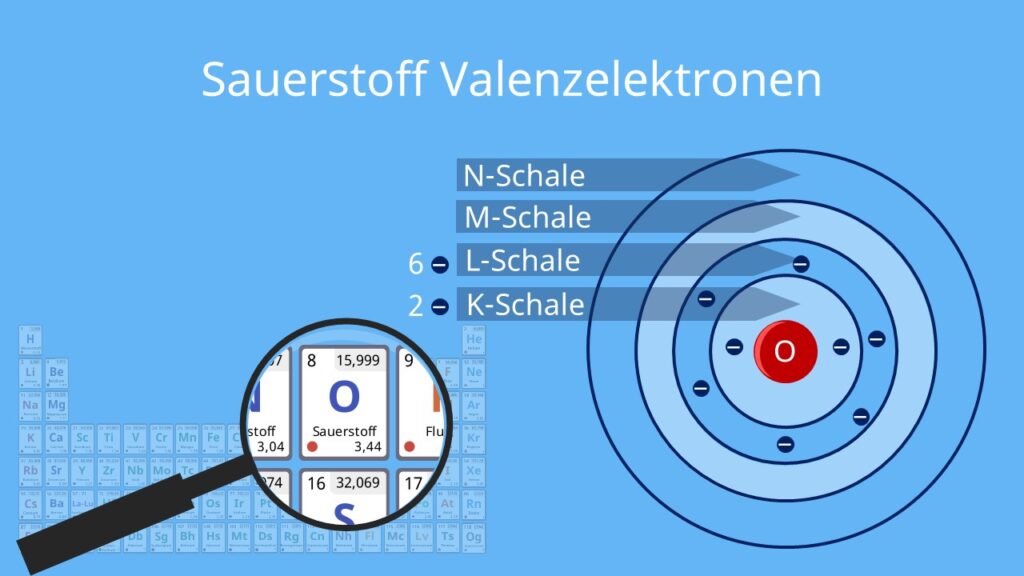
Die Rolle der Valenzelektronen
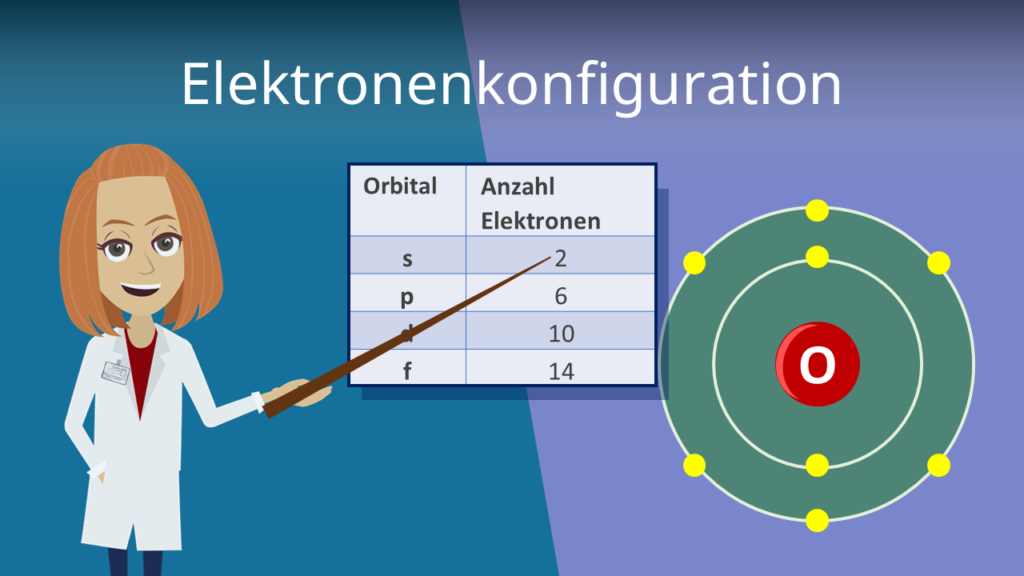
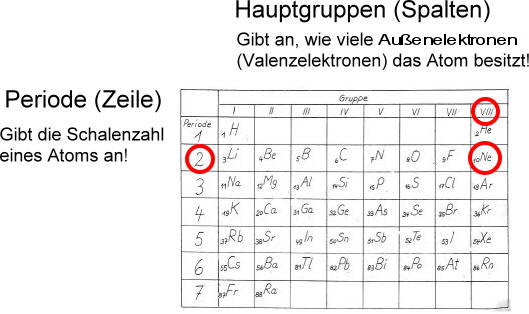
Ein wichtiger Aspekt der Ausstellung ist die Bedeutung der Valenzelektronen. Valenzelektronen sind die Elektronen in der äußersten Schale eines Atoms und bestimmen seine chemischen Eigenschaften. Die Ausstellung erklärt, wie die Anzahl der Valenzelektronen die Reaktivität eines Elements bestimmt und wie Elemente mit der gleichen Anzahl von Valenzelektronen ähnliche chemische Eigenschaften aufweisen. Eine interaktive Karte des Periodensystems hebt die Elemente hervor, die die gleiche Anzahl an Valenzelektronen haben und veranschaulicht ihre chemische Verwandtschaft.
Um die Bedeutung der Valenzelektronen für die chemische Bindung zu demonstrieren, wird ein Modell eines Moleküls, beispielsweise Wasser (H2O), gezeigt. Die Ausstellung erklärt, wie Sauerstoff sechs Valenzelektronen und jedes Wasserstoffatom ein Valenzelektron besitzt. Durch das Teilen von Elektronen bilden sie kovalente Bindungen und erreichen eine stabile Elektronenkonfiguration. Eine animierte Sequenz zeigt den Prozess der Bindungsbildung und die resultierende Verteilung der Elektronendichte im Wassermolekül.
Die Anwendung: Materialien, Medizin und Technologie
Der letzte Bereich der Ausstellung widmet sich den Anwendungen des Wissens über die Elektronenkonfiguration. Hier werden Beispiele aus verschiedenen Bereichen vorgestellt: Materialienwissenschaft, Medizin und Technologie. Die Leitfähigkeit von Metallen wird durch die delokalisierten Elektronen in ihrer äußeren Schale erklärt. Die Halbleitereigenschaften von Silizium werden durch seine Elektronenkonfiguration und die Möglichkeit, sie durch Dotierung zu verändern, veranschaulicht. In der Medizin wird die Wechselwirkung von Medikamenten mit biologischen Molekülen durch die Elektronenkonfiguration der beteiligten Atome bestimmt. Die Ausstellung zeigt Animationen, die die Prinzipien der Wechselwirkung von Medikamenten mit Rezeptoren auf zellulärer Ebene darstellen. Eine VR-Simulation ermöglicht es den Besuchern, ein virtuelles Medikamentenmolekül zu "manipulieren" und zu beobachten, wie es an ein Rezeptorprotein bindet.
Ein besonderer Fokus liegt auf der Entwicklung neuer Materialien. Die Ausstellung zeigt Beispiele für Nanomaterialien, die aufgrund ihrer einzigartigen Elektronenkonfigurationen außergewöhnliche Eigenschaften aufweisen. Carbon-Nanoröhren sind beispielsweise extrem stark und leitfähig. Graphen, eine einzelne Schicht von Kohlenstoffatomen, ist ebenfalls extrem stark und flexibel. Die Ausstellung erklärt, wie die Elektronenkonfiguration dieser Materialien ihre außergewöhnlichen Eigenschaften bestimmt und wie sie in verschiedenen Anwendungen eingesetzt werden können.
Die Ausstellung schließt mit einem Ausblick auf die Zukunft. Die Forschung im Bereich der Quantencomputer basiert auf der Manipulation von Quantenzuständen von Elektronen. Die Entwicklung neuer Batterietechnologien erfordert ein tiefes Verständnis der Elektronenkonfiguration der beteiligten Materialien. Die Ausstellung betont, dass das Verständnis der Elektronenkonfiguration weiterhin eine Schlüsselrolle bei der Lösung globaler Herausforderungen spielen wird.
Der Besuchereffekt: Erkenntnis und Inspiration
Das Ziel dieser Ausstellung ist es, den Besuchern ein tiefes und nachhaltiges Verständnis der Elektronenkonfiguration zu vermitteln. Durch die Kombination von interaktiven Exponaten, anschaulichen Visualisierungen und praktischen Anwendungen wird das abstrakte Konzept für ein breites Publikum zugänglich. Die Ausstellung soll nicht nur informieren, sondern auch inspirieren. Indem sie die Schönheit und die Kraft der zugrunde liegenden Prinzipien der Chemie offenbart, soll sie das Interesse an Wissenschaft und Technologie wecken und junge Menschen dazu ermutigen, eine Karriere in diesen Bereichen in Betracht zu ziehen. Die Ausstellung ist so konzipiert, dass sie für Besucher jeden Alters und Hintergrunds zugänglich ist, von Schülern und Studenten bis hin zu Familien und der breiten Öffentlichkeit. Durch die Vermittlung von Wissen und die Förderung des Verständnisses trägt sie dazu bei, die wissenschaftliche Kompetenz der Gesellschaft zu verbessern und eine informiertere Entscheidungsfindung in Bezug auf wissenschaftliche und technologische Fragen zu fördern.

![Wie Viele Elektronen Pro Schale Schalenmodell • Aufbau und Elektronenschalen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/03/WP_Schalenmodell_5_edelgase-2-1024x576.jpg)
![Wie Viele Elektronen Pro Schale Schalenmodell • Aufbau und Elektronenschalen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/03/WP_Schalenmodell_6_schalen-1024x576.jpg)
![Wie Viele Elektronen Pro Schale Schalenmodell • Aufbau und Elektronenschalen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/03/WP_Schalenmodell_1_sauerstoff-1-1024x576.jpg)