Wie Viele Valenzelektronen Hat Sauerstoff
Sauerstoff ist ein allgegenwärtiges Element und essenziell für das Leben, wie wir es kennen. Ein grundlegendes Verständnis seiner chemischen Eigenschaften ist nicht nur für angehende Chemiker, sondern auch für jeden nützlich, der sich mit alltäglichen Phänomenen und Prozessen auseinandersetzt. Eine dieser Schlüsseleigenschaften ist die Anzahl seiner Valenzelektronen. Dieser Artikel erklärt verständlich, wie viele Valenzelektronen Sauerstoff hat und warum das so wichtig ist.
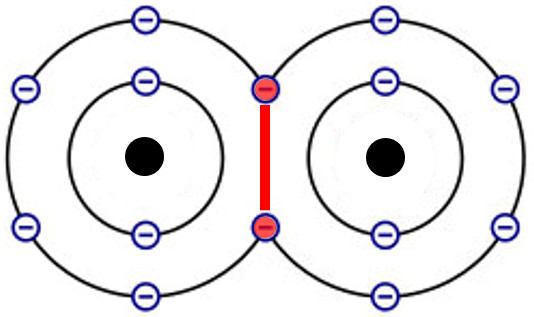
Was sind Valenzelektronen?
Bevor wir uns Sauerstoff zuwenden, ist es wichtig, den Begriff Valenzelektronen zu definieren. Valenzelektronen sind die Elektronen, die sich in der äußersten Elektronenschale (Valenzschale) eines Atoms befinden. Diese Elektronen sind maßgeblich an der chemischen Bindung mit anderen Atomen beteiligt. Atome "streben" danach, eine voll besetzte Valenzschale zu erreichen, was in der Regel acht Elektronen (Oktettregel) bedeutet (mit Ausnahme von Wasserstoff und Helium, die mit zwei Elektronen eine voll besetzte Schale erreichen). Um dieses Ziel zu erreichen, können Atome Elektronen abgeben, aufnehmen oder teilen. Diese Interaktionen bilden die Grundlage chemischer Reaktionen und der Bildung von Molekülen.
Die Anzahl der Valenzelektronen bestimmt also weitgehend, wie ein Atom mit anderen Atomen reagiert und welche Art von chemischen Bindungen es eingehen kann. Elemente mit wenigen Valenzelektronen neigen dazu, diese abzugeben, um eine voll besetzte innere Schale zu erreichen, während Elemente mit fast voll besetzter Valenzschale eher Elektronen aufnehmen.
Die Elektronische Konfiguration von Sauerstoff
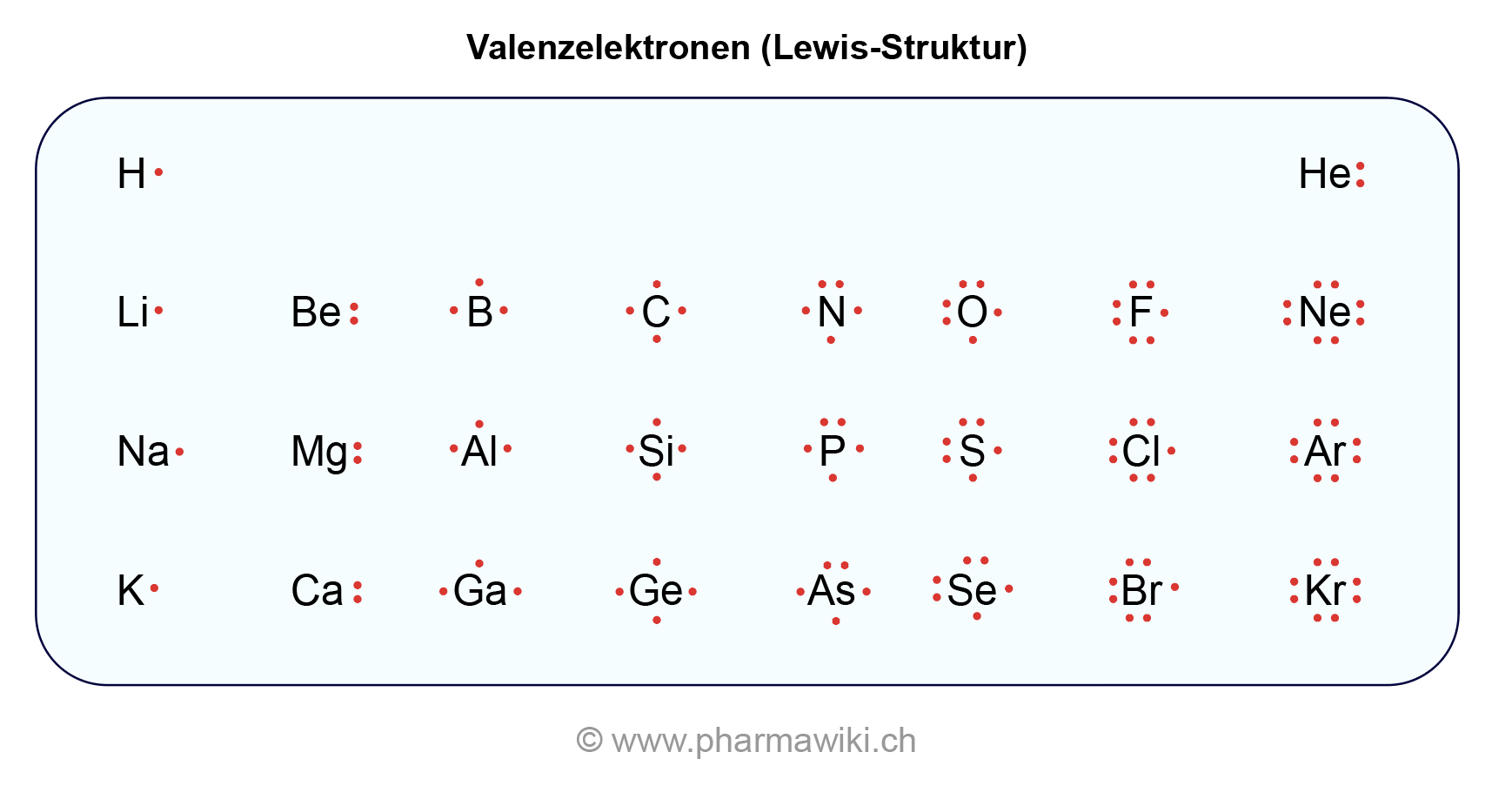
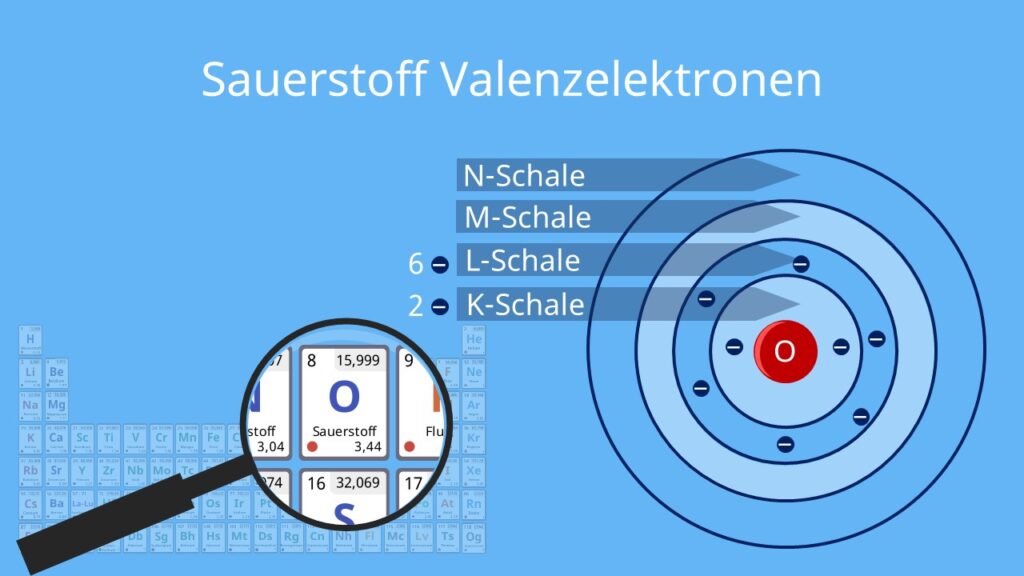
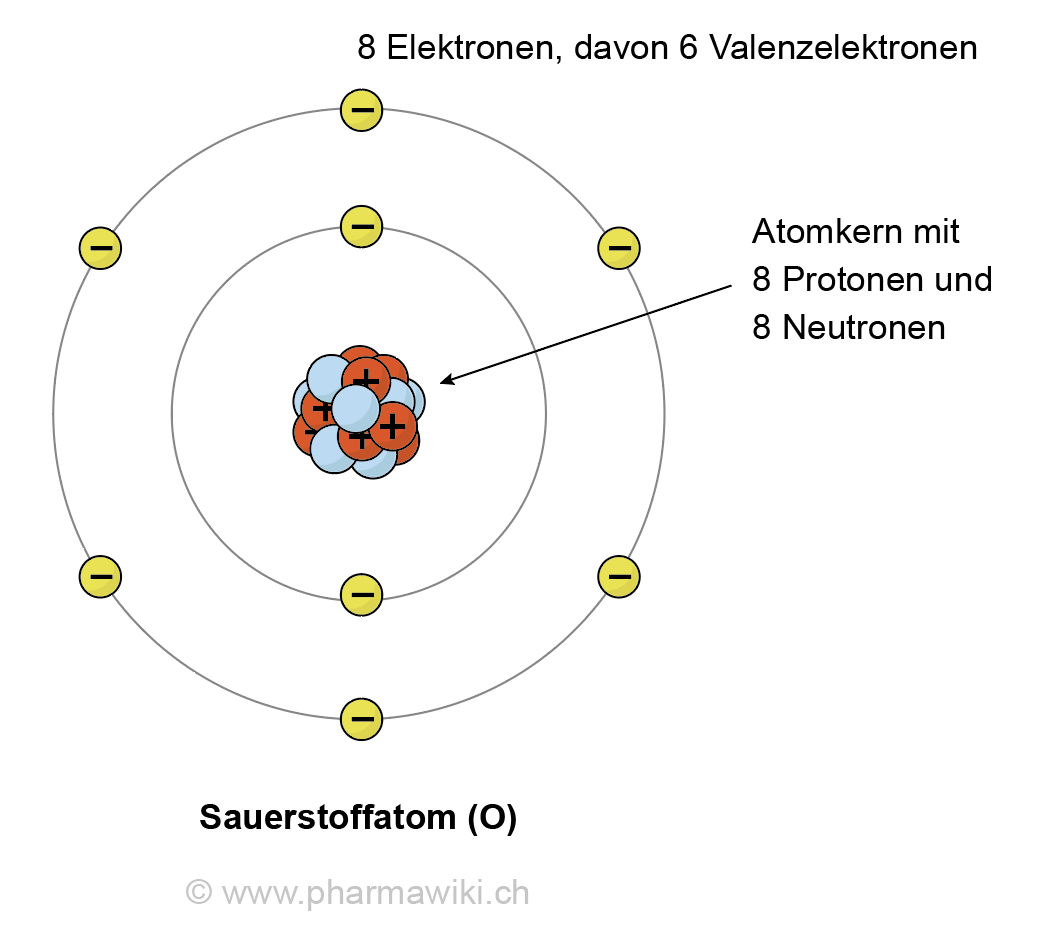
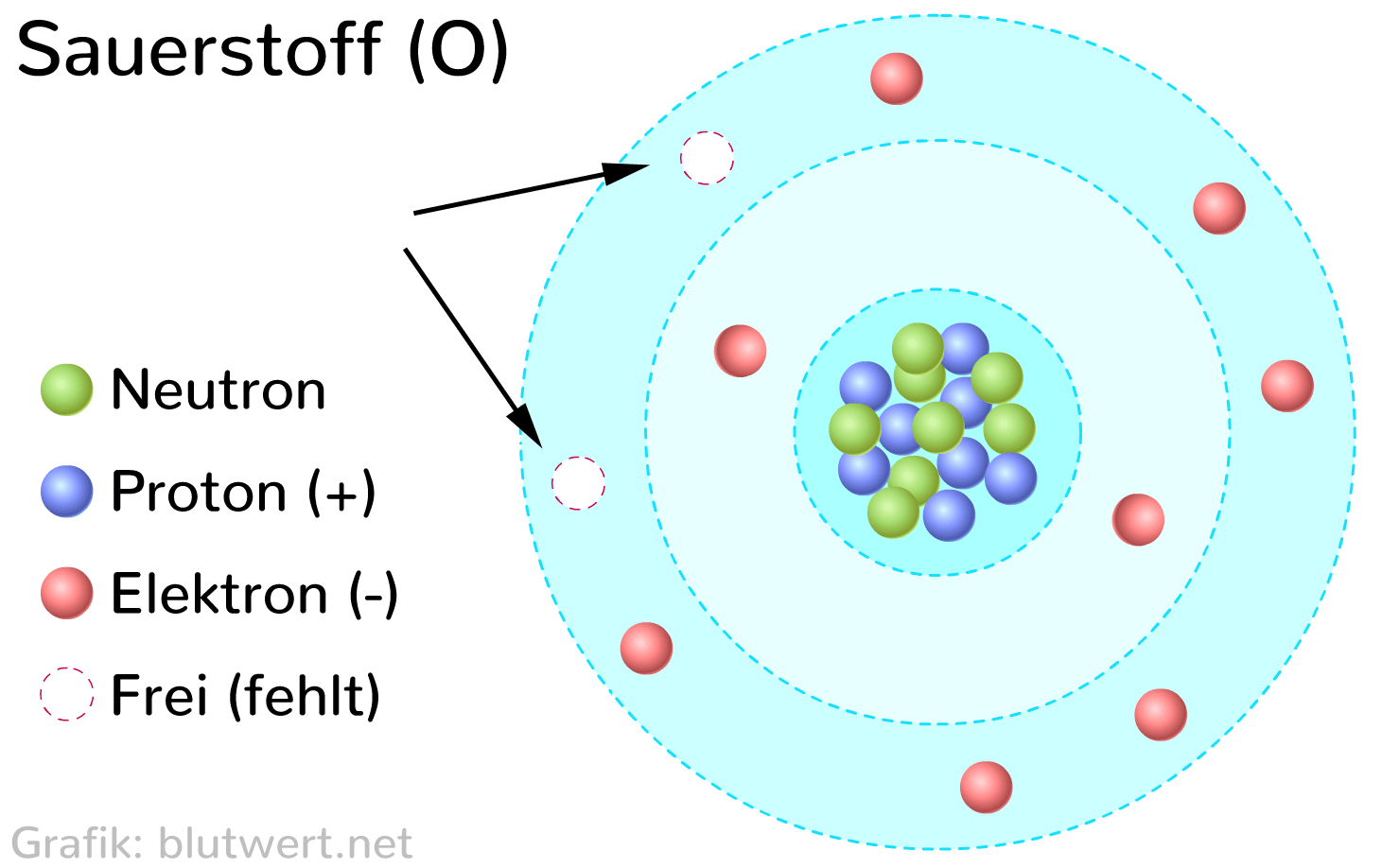
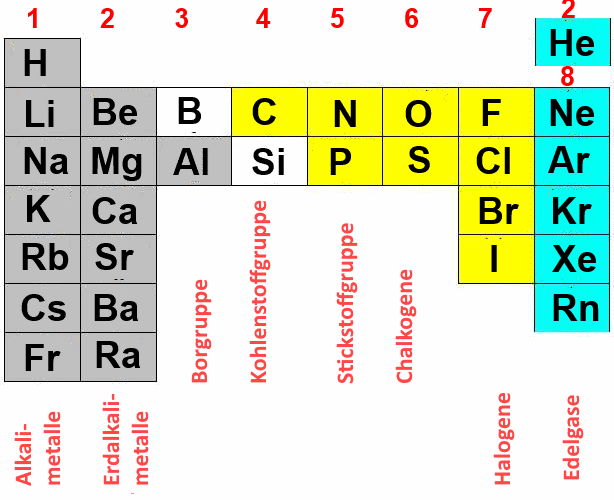
Um die Anzahl der Valenzelektronen von Sauerstoff zu bestimmen, müssen wir uns seine elektronische Konfiguration ansehen. Sauerstoff (Symbol: O) hat die Ordnungszahl 8, was bedeutet, dass ein neutrales Sauerstoffatom 8 Protonen im Kern und 8 Elektronen in den Elektronenschalen besitzt.
Die Elektronenkonfiguration von Sauerstoff ist 1s2 2s2 2p4. Dies bedeutet:
- 1s2: Die innerste Elektronenschale (die erste Schale) ist mit zwei Elektronen gefüllt.
- 2s2: Die zweite Schale (die Valenzschale) hat zwei Elektronen im s-Orbital.
- 2p4: Die zweite Schale hat außerdem vier Elektronen im p-Orbital.
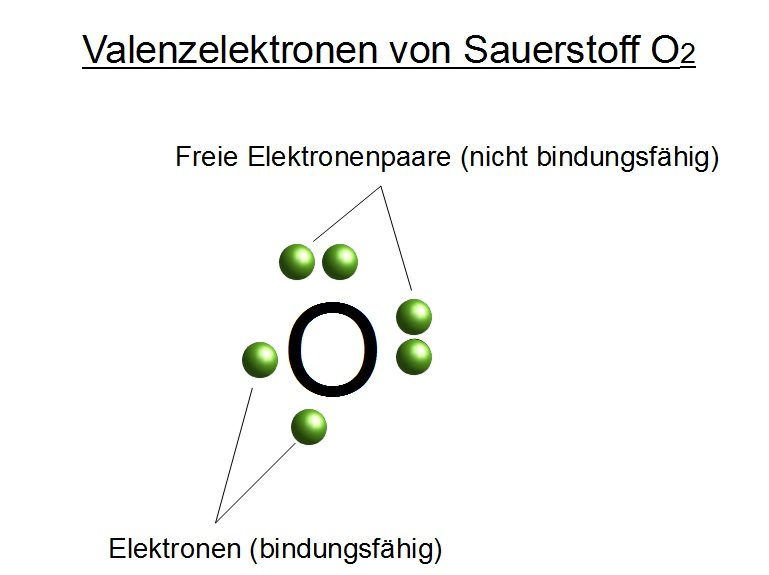
Die Valenzschale von Sauerstoff ist also die zweite Schale (n=2), die insgesamt 2 (2s2) + 4 (2p4) = 6 Elektronen enthält.
Sauerstoff hat sechs Valenzelektronen
Daraus folgt, dass Sauerstoff sechs Valenzelektronen besitzt. Diese sechs Elektronen in der äußeren Schale sind entscheidend für die chemischen Eigenschaften von Sauerstoff.
Warum ist das wichtig?
Die Tatsache, dass Sauerstoff sechs Valenzelektronen hat, erklärt seine hohe Reaktivität und seine Fähigkeit, mit einer Vielzahl von anderen Elementen Verbindungen einzugehen. Da Sauerstoff nur zwei weitere Elektronen benötigt, um die Oktettregel zu erfüllen und eine stabile Elektronenkonfiguration zu erreichen, ist er bestrebt, Bindungen einzugehen.
Reaktionsfreudigkeit von Sauerstoff
Die Reaktionsfreudigkeit von Sauerstoff ist ein direktes Ergebnis seiner Valenzelektronen. Sauerstoff reagiert leicht mit vielen Elementen, um stabile Verbindungen zu bilden. Dies äußert sich in alltäglichen Prozessen wie:
- Oxidation (Verbrennung): Die Reaktion von Sauerstoff mit einem brennbaren Material, oft unter Freisetzung von Wärme und Licht. Zum Beispiel das Verbrennen von Holz oder Erdgas.
- Korrosion (Rosten): Die Reaktion von Sauerstoff mit Metallen, wie z.B. Eisen, was zur Bildung von Rost (Eisenoxid) führt.
- Atmung: Lebewesen nutzen Sauerstoff, um Nahrung in Energie umzuwandeln. Dabei reagiert Sauerstoff mit organischen Molekülen.
Bindungsverhalten von Sauerstoff
Sauerstoff kann verschiedene Arten von chemischen Bindungen eingehen, um seine Valenzschale zu vervollständigen:
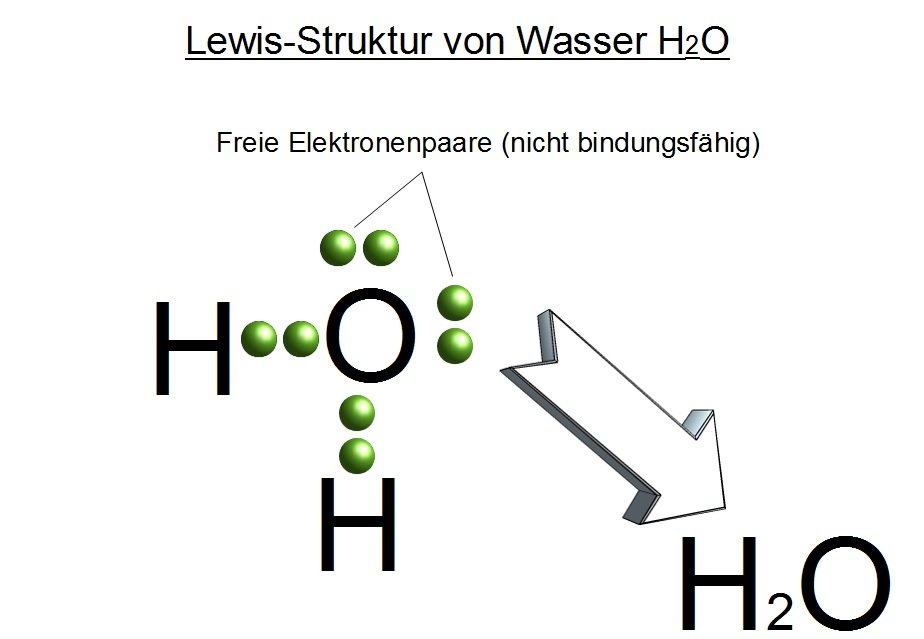
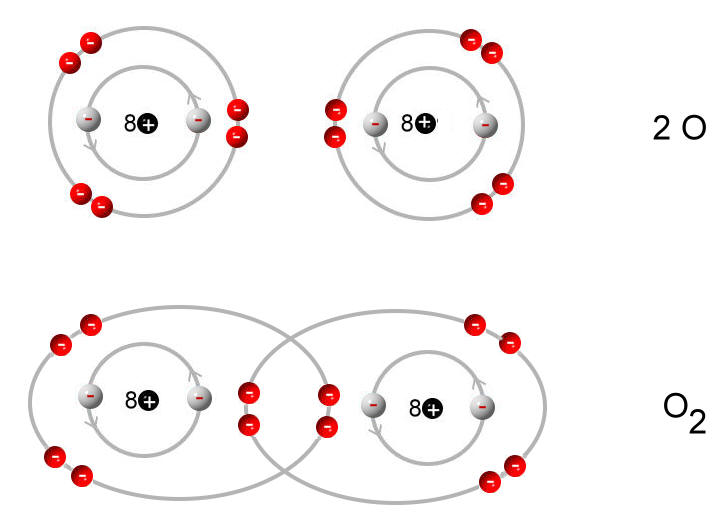
- Kovalente Bindungen: Sauerstoff teilt Elektronen mit anderen Atomen, um eine stabile Konfiguration zu erreichen. Ein bekanntes Beispiel ist die Bildung von Wasser (H2O). Jedes Wasserstoffatom teilt ein Elektron mit dem Sauerstoffatom, wodurch Sauerstoff zwei zusätzliche Elektronen erhält und somit acht Elektronen in seiner Valenzschale besitzt. Die Bindungen zwischen den Atomen sind kovalente Bindungen. Sauerstoff kann auch Doppelbindungen eingehen, wie im Sauerstoffmolekül (O2), wo sich zwei Sauerstoffatome jeweils zwei Elektronenpaare teilen.
- Ionenbindungen: Sauerstoff kann auch Elektronen von anderen Atomen aufnehmen, um eine negative Ladung zu erhalten (Anion). Ein Beispiel ist die Bildung von Metalloxiden, bei denen Sauerstoff Elektronen von einem Metallatom aufnimmt, um eine ionische Bindung zu bilden.
Die Bedeutung von Sauerstoff in der Chemie und Biologie
Die chemischen Eigenschaften von Sauerstoff, die durch seine Valenzelektronen bestimmt werden, machen ihn zu einem der wichtigsten Elemente in der Chemie und Biologie. Sauerstoff ist ein Bestandteil vieler organischer Moleküle, wie z.B. Kohlenhydrate, Fette und Proteine. Er spielt eine entscheidende Rolle im Stoffwechsel, bei der Energiegewinnung und der Synthese lebenswichtiger Verbindungen.
In der Atmosphäre ist Sauerstoff in Form von O2 (molekularer Sauerstoff) und O3 (Ozon) vorhanden. Molekularer Sauerstoff ist für die Atmung der meisten Lebewesen unerlässlich. Ozon schützt die Erdoberfläche vor schädlicher ultravioletter Strahlung der Sonne.
Zusammenfassung
Zusammenfassend lässt sich sagen, dass Sauerstoff sechs Valenzelektronen hat. Diese Anzahl an Valenzelektronen ist der Schlüssel zu seiner hohen Reaktivität und seiner Fähigkeit, stabile Verbindungen mit einer Vielzahl anderer Elemente einzugehen. Von der Verbrennung bis zur Atmung und der Bildung von Wasser ist Sauerstoff ein unverzichtbarer Bestandteil vieler wichtiger Prozesse, die das Leben auf der Erde ermöglichen.
Das Verständnis der Valenzelektronen von Sauerstoff hilft nicht nur, seine chemischen Eigenschaften zu verstehen, sondern auch die Rolle, die er in vielen alltäglichen und industriellen Prozessen spielt.
Weitere Informationen
Wenn Sie mehr über dieses Thema erfahren möchten, können Sie folgende Ressourcen konsultieren:
- Lehrbücher der Chemie
- Online-Enzyklopädien wie Wikipedia (Suche nach "Sauerstoff" und "Valenzelektronen")
- Websites und Videos zum Thema Chemie, z. B. Khan Academy



![Wie Viele Valenzelektronen Hat Sauerstoff Sauerstoff • einfach erklärt: Steckbrief, Nachweis · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/04/Sauerstoff-Schalenmodell-1024x576.jpg)

![Wie Viele Valenzelektronen Hat Sauerstoff Periodensystem • Übersicht der chemischen Elemente · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/12/WP-Bild_Schalenmodell-für-Helium-und-Neon-1-1024x576.jpg)