Bei Welcher Temperatur Hat Wasser Die Größte Dichte
Wasser ist eine der am häufigsten vorkommenden Substanzen auf der Erde und spielt eine entscheidende Rolle in unserem Leben und in der Umwelt. Obwohl wir es täglich verwenden, sind seine physikalischen Eigenschaften nicht immer intuitiv. Eine besonders interessante Eigenschaft ist die Dichte, also das Verhältnis von Masse zu Volumen. Während die Dichte der meisten Stoffe mit sinkender Temperatur stetig zunimmt, verhält sich Wasser anders. Dieser Artikel erklärt, bei welcher Temperatur Wasser seine größte Dichte erreicht und warum das so ist. Das Verständnis dieser Anomalie ist wichtig, um viele natürliche Phänomene zu verstehen.
Die Dichte von Wasser: Eine Einführung
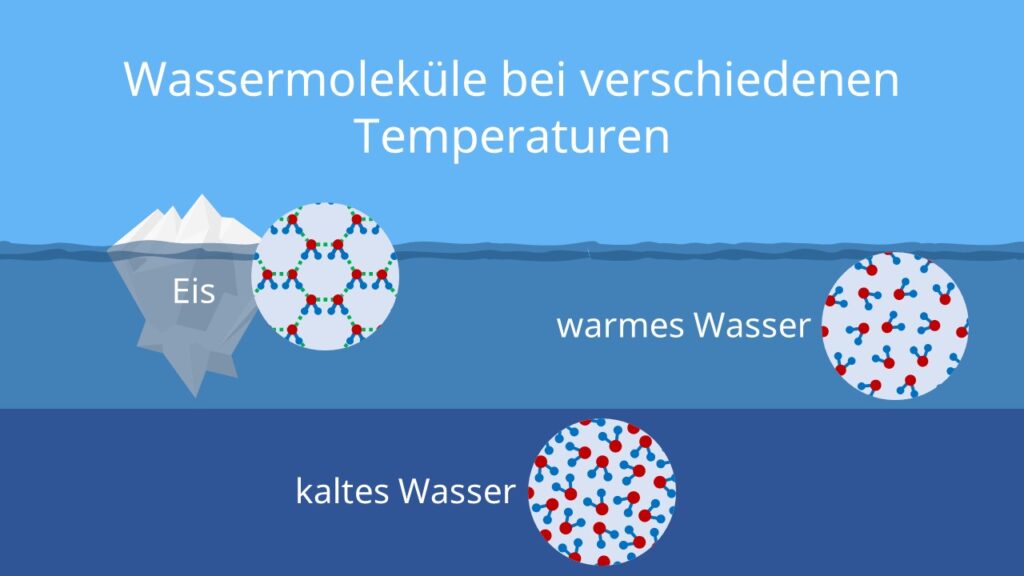
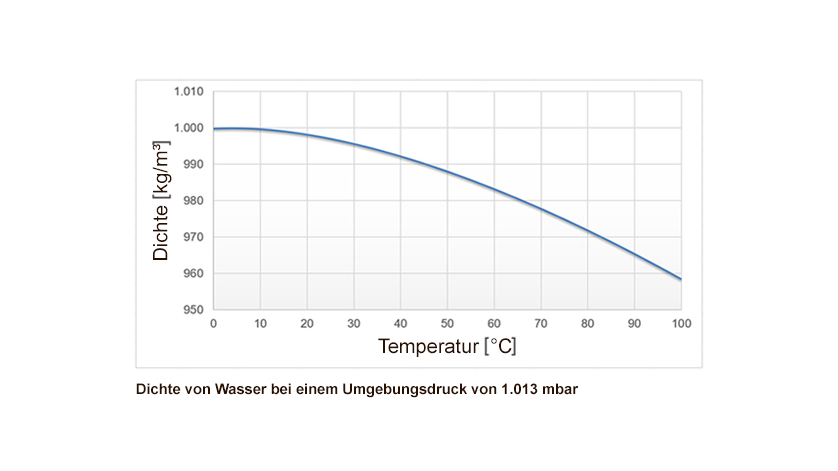
Die Dichte eines Stoffes gibt an, wie viel Masse in einem bestimmten Volumen enthalten ist. Sie wird typischerweise in Kilogramm pro Kubikmeter (kg/m³) oder Gramm pro Kubikzentimeter (g/cm³) gemessen. Im Allgemeinen nehmen die meisten Stoffe an Dichte zu, wenn sie abkühlen. Das liegt daran, dass sich die Moleküle bei niedrigeren Temperaturen langsamer bewegen und näher zusammenrücken. Wasser folgt diesem Muster jedoch nicht linear.
Das ungewöhnliche Verhalten von Wasser
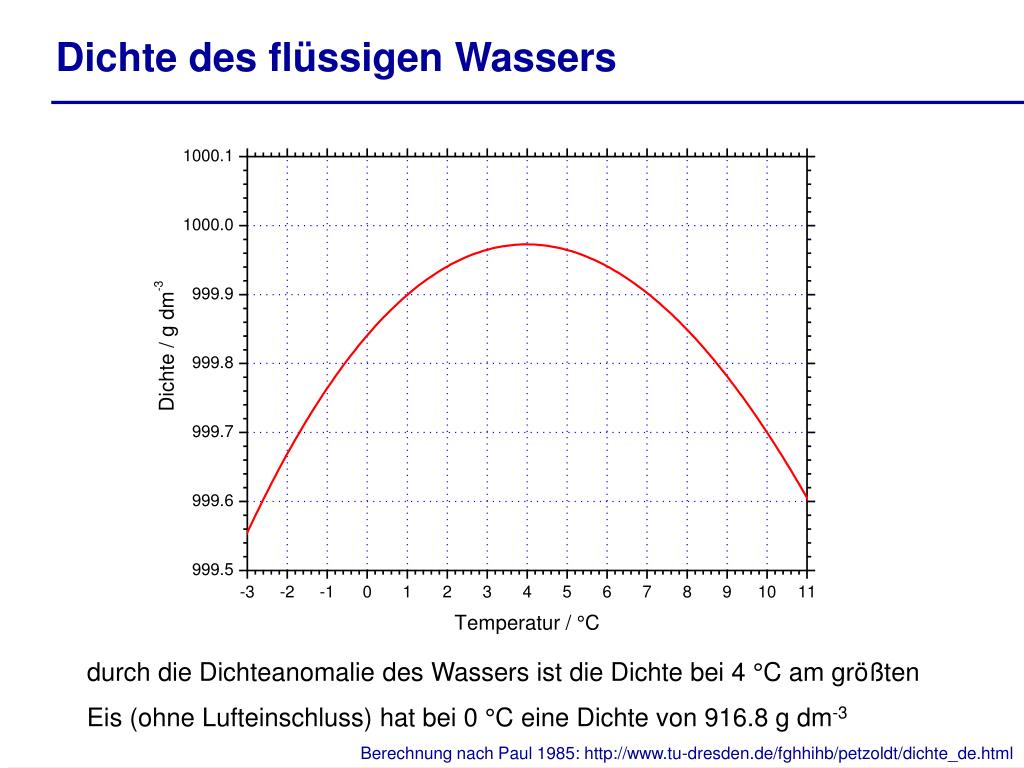
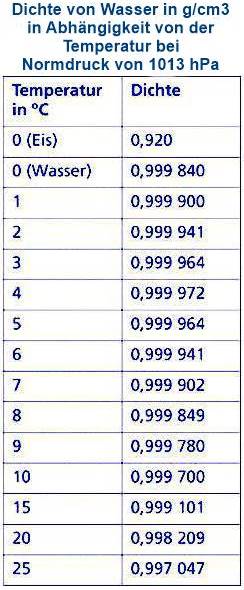
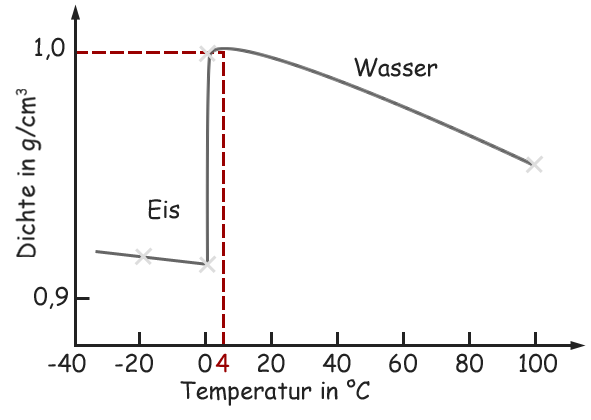
Wasser zeigt ein ungewöhnliches Dichteverhalten. Anstatt bei seinem Gefrierpunkt (0°C) die höchste Dichte zu erreichen, erreicht es seine maximale Dichte bei etwa 3,98°C (oft aufgerundet auf 4°C). Das bedeutet, dass Wasser zwischen seinem Gefrierpunkt und 4°C eine anomale Ausdehnung erfährt: Es dehnt sich aus, wenn es abkühlt. Dieses Verhalten hat weitreichende Konsequenzen für das Leben in Gewässern und für das Klima.
Warum ist das so? Die Wasserstoffbrückenbindung
Die Erklärung für dieses anomale Verhalten liegt in der molekularen Struktur des Wassers und den Wasserstoffbrückenbindungen. Ein Wassermolekül (H₂O) besteht aus einem Sauerstoffatom und zwei Wasserstoffatomen. Das Sauerstoffatom ist stärker elektronegativ als die Wasserstoffatome, was bedeutet, dass es die Elektronen stärker anzieht. Dadurch entsteht eine partielle negative Ladung am Sauerstoffatom und partielle positive Ladungen an den Wasserstoffatomen. Diese Ladungsverteilung ermöglicht es Wassermolekülen, sich durch Wasserstoffbrückenbindungen aneinander zu binden. Diese Bindungen sind relativ schwach, aber zahlreich und beeinflussen die Eigenschaften des Wassers stark.
Bei höheren Temperaturen bewegen sich die Wassermoleküle schnell und die Wasserstoffbrückenbindungen werden ständig gebrochen und neu gebildet. Wenn die Temperatur sinkt, verlangsamen sich die Moleküle und die Wasserstoffbrückenbindungen werden stabiler und stärker. Bei Temperaturen über 4°C überwiegt der Effekt der thermischen Kontraktion, d.h. die Moleküle rücken näher zusammen, wodurch die Dichte zunimmt. Zwischen 4°C und 0°C beginnt jedoch ein anderer Effekt zu dominieren: Die Wasserstoffbrückenbindungen beginnen, eine tetraedrische Struktur zu bilden, die mehr Raum einnimmt. Diese tetraedrische Anordnung führt dazu, dass die Moleküle weiter auseinanderliegen als bei 4°C, wodurch das Volumen zunimmt und die Dichte abnimmt.
Die tetraedrische Struktur
Die tetraedrische Struktur entsteht, weil jedes Wassermolekül idealerweise vier Wasserstoffbrückenbindungen zu anderen Wassermolekülen eingeht. Im festen Zustand, also im Eis, ist diese tetraedrische Struktur voll ausgeprägt und führt zu einer relativ offenen, kristallinen Struktur. Dadurch ist Eis weniger dicht als flüssiges Wasser bei 4°C. Dieses Phänomen ist äußerst wichtig für aquatische Ökosysteme.
Die Bedeutung der maximalen Dichte bei 4°C
Das Verhalten von Wasser, seine maximale Dichte bei 4°C zu erreichen, hat weitreichende Folgen für die Umwelt und das Leben auf der Erde:
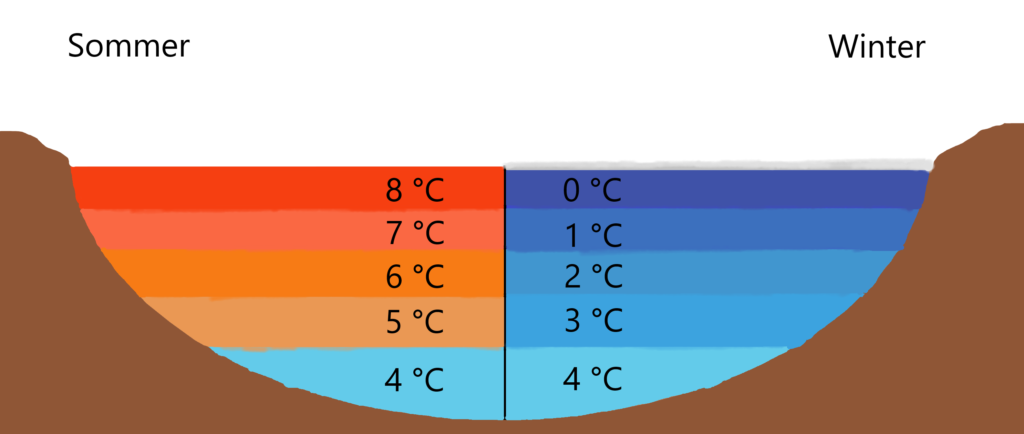
- Seen und Flüsse frieren von oben nach unten zu: Im Winter kühlt das Oberflächenwasser eines Sees oder Flusses ab. Wenn die Temperatur 4°C erreicht, sinkt dieses Wasser ab, da es die höchste Dichte hat. Dadurch wird wärmeres Wasser aus der Tiefe nach oben befördert. Dieser Prozess setzt sich fort, bis das gesamte Wasservolumen 4°C erreicht hat. Kühlt die Oberfläche weiter ab, wird das Wasser leichter und bleibt an der Oberfläche. Schließlich gefriert das Oberflächenwasser zu Eis. Da Eis weniger dicht ist als Wasser, schwimmt es auf der Oberfläche und bildet eine isolierende Schicht. Diese isolierende Eisschicht schützt das darunterliegende Wasser vor dem Gefrieren und ermöglicht es aquatischen Organismen, im Winter zu überleben. Ohne diese Anomalie würden Seen und Flüsse von unten nach oben zufrieren, was das Überleben von Fischen und anderen Wasserlebewesen unmöglich machen würde.
- Zirkulation in Ozeanen: Die Dichte von Wasser beeinflusst auch die Zirkulationsmuster in den Ozeanen. Kaltes, salzhaltiges Wasser ist dichter als warmes, weniger salzhaltiges Wasser und sinkt ab. Diese Dichteunterschiede treiben die thermohaline Zirkulation an, ein globales Strömungssystem, das Wärme um die Erde transportiert und das Klima beeinflusst.
- Verwitterung von Gesteinen: Das Gefrieren von Wasser in Gesteinsspalten kann zur Verwitterung beitragen. Wenn Wasser gefriert, dehnt es sich aus (um etwa 9%), wodurch Druck auf die umgebenden Gesteine ausgeübt wird. Dieser Druck kann dazu führen, dass die Gesteine aufbrechen und zerbröseln, ein Prozess, der als Frostsprengung bekannt ist.
Praktische Anwendungen und Beobachtungen
Obwohl die maximale Dichte von Wasser bei 4°C ein eher wissenschaftliches Konzept ist, hat es auch praktische Auswirkungen und kann in Alltagssituationen beobachtet werden.
- Teiche im Winter: Wenn Sie einen Teich im Winter beobachten, werden Sie feststellen, dass die Fische oft in der Tiefe des Teiches überleben, auch wenn die Oberfläche zugefroren ist. Das liegt daran, dass das Wasser am Grund des Teiches eine Temperatur von etwa 4°C hat, was für die Fische ausreichend warm ist, um zu überleben.
- Eiswürfel in Getränken: Eiswürfel schwimmen in Ihrem Getränk, weil Eis weniger dicht ist als flüssiges Wasser.
Zusammenfassung
Die maximale Dichte von Wasser wird bei etwa 3,98°C (oder 4°C) erreicht. Dieses ungewöhnliche Verhalten ist auf die Wasserstoffbrückenbindungen zwischen den Wassermolekülen und die daraus resultierende tetraedrische Struktur zurückzuführen. Diese Anomalie hat wichtige Konsequenzen für das Leben in Gewässern, die Zirkulation in den Ozeanen und die Verwitterung von Gesteinen. Ohne diese spezielle Eigenschaft des Wassers wäre das Leben, wie wir es kennen, auf der Erde nicht möglich. Die Fähigkeit von Seen und Flüssen, von oben nach unten zuzufrieren, ermöglicht es aquatischen Organismen, den Winter zu überleben, während die thermohaline Zirkulation das globale Klima beeinflusst.
Das Verständnis der physikalischen Eigenschaften von Wasser, einschließlich seiner Dichteanomalie, ist entscheidend für das Verständnis vieler natürlicher Phänomene und für die Entwicklung von Technologien, die auf Wasser angewiesen sind. Die scheinbar einfache Substanz Wasser birgt also noch immer viele Geheimnisse und ist Gegenstand intensiver Forschung.
![Bei Welcher Temperatur Hat Wasser Die Größte Dichte Anomalie des Wassers • Erklärung und Beispiel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/01/WP_Anomalie-des-Wassers_2_dichte-1-1024x576.jpg)

![Bei Welcher Temperatur Hat Wasser Die Größte Dichte Anomalie des Wassers • Erklärung und Beispiel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/01/WP_Anomalie-des-Wassers_1_volumen-1024x576.jpg)
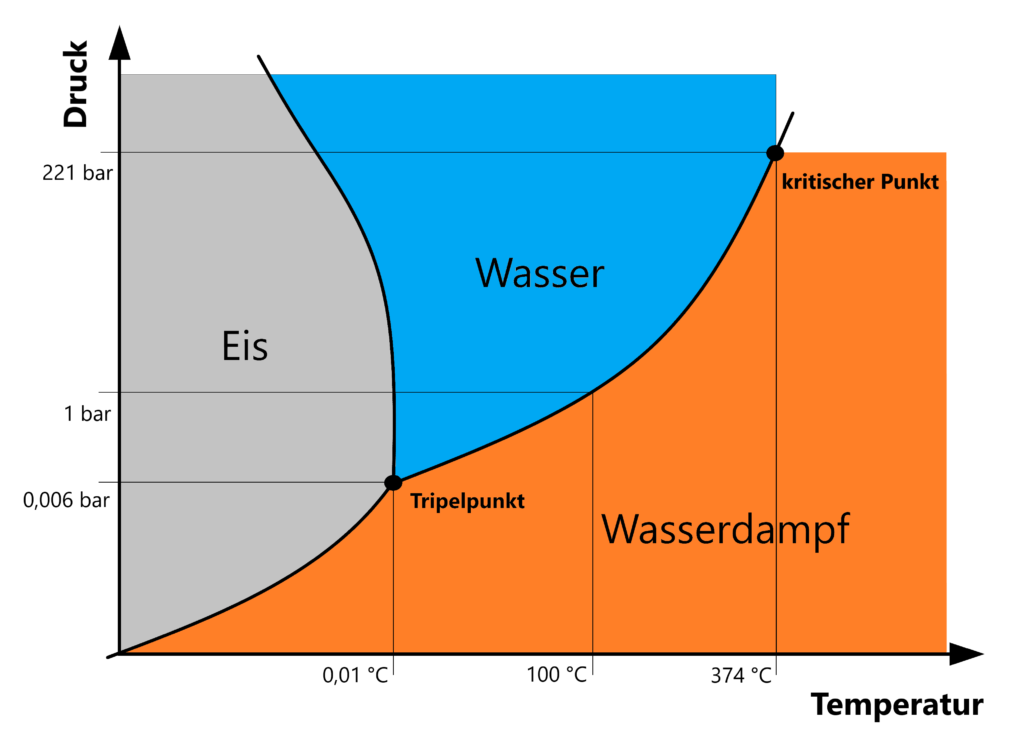
![Bei Welcher Temperatur Hat Wasser Die Größte Dichte Phasendiagramm Wasser · Aufbau & Erklärung · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2019/09/Phasendiagramm-Wasser_Tripelpunkt-Wasser-1024x576.jpg)

![Bei Welcher Temperatur Hat Wasser Die Größte Dichte Anomalie des Wassers • Erklärung und Beispiel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/01/WP_Anomalie-des-Wassers_3_teilchen-1024x576.jpg)



![Bei Welcher Temperatur Hat Wasser Die Größte Dichte Anomalie des Wassers • Erklärung und Beispiel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/01/WP_Anomalie-des-Wassers_5_dichte-1-1024x576.jpg)