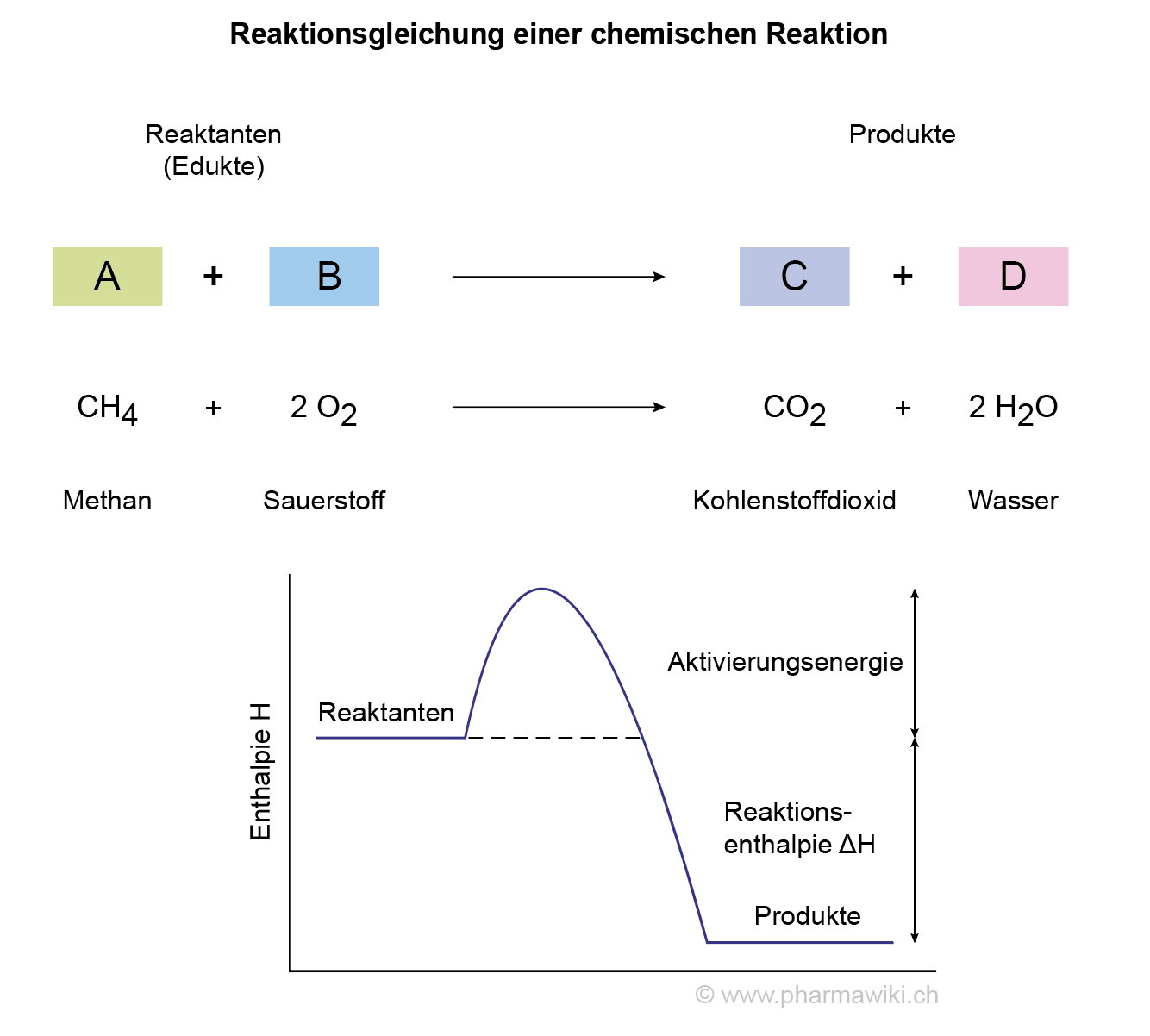
Beispiele Für Chemische Reaktionen Im Alltag

Willkommen in Deutschland! Eines der faszinierendsten Dinge am Reisen ist, die Welt mit neuen Augen zu sehen – und dabei auch die kleinen Dinge des Alltags zu schätzen. Haben Sie jemals darüber nachgedacht, dass viele dieser alltäglichen Dinge das Ergebnis chemischer Reaktionen sind? Keine Sorge, Sie müssen kein Chemiker sein, um das zu verstehen! In diesem Artikel zeige ich Ihnen einige spannende Beispiele für chemische Reaktionen, die uns in Deutschland tagtäglich begegnen – von der Zubereitung Ihres Frühstücks bis hin zum Betanken Ihres Autos. Lassen Sie uns eintauchen in die Welt der Chemie, die überall um uns herum stattfindet!
Kochen & Backen: Die Chemie in Ihrer Küche
Die Küche ist ein wahres Chemielabor! Viele der Prozesse, die wir beim Kochen und Backen beobachten, sind in Wirklichkeit chemische Reaktionen. Hier sind einige Beispiele:
Das Aufgehen von Kuchen: Backpulver und Hefe
Wenn Sie einen Kuchen backen, sorgen Backpulver oder Hefe dafür, dass der Teig schön locker und fluffig wird. Backpulver enthält Natriumhydrogencarbonat (NaHCO₃) und eine Säure. Wenn diese mit Wasser in Berührung kommen, reagieren sie miteinander und bilden Kohlendioxid (CO₂). Dieses Gas bildet Bläschen im Teig, die ihn aufgehen lassen. Die chemische Formel dazu lautet vereinfacht: 2 NaHCO₃ → Na₂CO₃ + H₂O + CO₂. Die Hefe hingegen ist ein lebender Organismus, der Zucker abbaut und dabei ebenfalls CO₂ produziert. Das Ergebnis ist das gleiche: ein lockerer, luftiger Kuchen!
Das Bräunen von Brot: Die Maillard-Reaktion
Diese Reaktion ist für die köstliche braune Kruste und den charakteristischen Geschmack von Brot, gebratenem Fleisch und gerösteten Kaffeebohnen verantwortlich. Die Maillard-Reaktion ist eine komplexe Abfolge von Reaktionen zwischen Aminosäuren (Bestandteile von Proteinen) und reduzierenden Zuckern unter Einwirkung von Hitze. Diese Reaktion erzeugt Hunderte verschiedener Aromastoffe, die jedes Lebensmittel einzigartig machen.
Das Schälen eines Eis: Eine Säure-Basen-Reaktion
Vielleicht haben Sie es selbst schon erlebt: Frisch gekochte Eier lassen sich oft schwer schälen. Warum? Während des Kochens gelangt etwas Schwefelwasserstoff (H₂S) aus dem Eiweiß in das Eigelb. Gleichzeitig diffundiert etwas Eisen (Fe) aus der Schale. Diese beiden Stoffe reagieren miteinander und bilden Eisensulfid (FeS), eine dunkle Schicht zwischen Eiweiß und Schale. Wenn das Ei jedoch einige Tage im Kühlschrank gelagert wird, verschwindet diese Schicht oft, da sich der pH-Wert verändert. Das Schälen wird einfacher.
Essig und Öl: Eine Emulsion
Ein einfaches Salatdressing aus Essig und Öl mag simpel erscheinen, ist aber tatsächlich ein Beispiel für eine Emulsion. Essig ist wasserbasiert und Öl ist fettbasiert. Normalerweise vermischen sich diese beiden Stoffe nicht. Wenn Sie sie jedoch kräftig schütteln oder einen Emulgator wie Senf hinzufügen, bilden sich kleine Öltröpfchen, die im Essig verteilt sind. Diese Mischung ist instabil und trennt sich mit der Zeit wieder, wenn sie nicht erneut geschüttelt wird.
Alltagsprodukte & Reinigungsmittel: Chemie im Haushalt
Auch außerhalb der Küche begegnen wir ständig chemischen Reaktionen:
Rostbildung: Oxidation
Rost, das unschöne orangefarbene Zeug auf Eisen und Stahl, ist das Ergebnis einer chemischen Reaktion namens Oxidation. Eisen reagiert mit Sauerstoff und Wasser in der Luft und bildet Eisenoxid (Fe₂O₃), besser bekannt als Rost. Diese Reaktion ist korrosiv und kann Metalle im Laufe der Zeit zerstören. Deshalb werden Metalle oft mit Farben, Lacken oder anderen Schutzschichten vor Rost geschützt. Die Formel für die Rostbildung lautet: 4 Fe + 3 O₂ + 6 H₂O → 4 Fe(OH)₃ (vereinfacht).
Reinigung mit Bleichmittel: Eine Redoxreaktion
Bleichmittel, wie Natriumhypochlorit (NaClO), wirkt als Oxidationsmittel. Es reagiert mit Farbstoffen und anderen organischen Molekülen, die Flecken verursachen, und verändert deren Struktur, sodass sie farblos werden. Diese Reaktion wird als Redoxreaktion bezeichnet, bei der ein Stoff Elektronen abgibt (oxidiert wird) und ein anderer Stoff Elektronen aufnimmt (reduziert wird). Achten Sie darauf, Bleichmittel niemals mit anderen Reinigungsmitteln, insbesondere mit ammoniakhaltigen Produkten, zu mischen, da dies gefährliche Gase freisetzen kann!
Das Anlaufen von Silber: Sulfidierung
Silberbesteck und Schmuck können mit der Zeit schwarz anlaufen. Dies liegt daran, dass Silber (Ag) mit Schwefelwasserstoff (H₂S) in der Luft reagiert und Silbersulfid (Ag₂S) bildet, eine dunkle Schicht auf der Oberfläche. Diese Reaktion wird als Sulfidierung bezeichnet. Sie können angelaufenes Silber mit speziellen Silberputzmitteln oder mit einem einfachen Hausmittel reinigen: Legen Sie das Silber zusammen mit Alufolie und etwas Salz in heißes Wasser. Die Alufolie wirkt als Opfermetall und zieht den Schwefel aus dem Silbersulfid heraus.
Seifen und Waschmittel: Tenside
Seifen und Waschmittel sind Tenside. Das bedeutet, dass sie Moleküle enthalten, die sowohl wasserliebende (hydrophile) als auch fettliebende (hydrophobe) Eigenschaften haben. Dadurch können sie Fett und Schmutz von Oberflächen lösen und in Wasser emulgieren, so dass sie leicht abgewaschen werden können. Diese Eigenschaft macht sie zu unverzichtbaren Helfern im Haushalt und bei der Körperpflege.
Transport & Energie: Chemische Reaktionen unterwegs
Auch beim Autofahren oder Heizen spielen chemische Reaktionen eine entscheidende Rolle:
Verbrennung von Kraftstoff: Exotherme Reaktion
Der Motor Ihres Autos funktioniert durch die Verbrennung von Kraftstoff (z.B. Benzin oder Diesel) mit Sauerstoff. Diese Verbrennung ist eine exotherme Reaktion, d.h. sie setzt Wärme frei. Die Wärmeenergie wird genutzt, um den Motor anzutreiben und das Auto in Bewegung zu setzen. Bei der Verbrennung entstehen auch Abgase wie Kohlendioxid (CO₂), Wasser (H₂O) und Stickoxide (NOx), die zur Luftverschmutzung beitragen. Deshalb ist es wichtig, auf umweltfreundliche Fahrzeuge und Kraftstoffe zu setzen.
Batterien: Elektrochemische Reaktionen
Batterien, die in Handys, Laptops und Elektroautos verwendet werden, basieren auf elektrochemischen Reaktionen. In der Batterie finden chemische Reaktionen statt, die Elektronen freisetzen. Diese Elektronen fließen durch einen Stromkreis und liefern Energie, um das Gerät zu betreiben. Die Art der chemischen Reaktionen hängt von der Art der Batterie ab (z.B. Lithium-Ionen-Batterien in Smartphones oder Blei-Säure-Batterien in Autos).
Heizung: Verbrennung oder Brennstoffzelle
In vielen deutschen Haushalten wird mit Gas oder Öl geheizt. Auch hier findet eine Verbrennung statt, bei der Brennstoff mit Sauerstoff reagiert und Wärme freisetzt. Eine umweltfreundlichere Alternative ist die Brennstoffzelle, die Wasserstoff (H₂) mit Sauerstoff (O₂) zu Wasser (H₂O) reagieren lässt. Diese Reaktion erzeugt ebenfalls Wärme und Strom, ist aber deutlich sauberer als die Verbrennung fossiler Brennstoffe.
Fazit
Wie Sie sehen, sind chemische Reaktionen allgegenwärtig und spielen eine wichtige Rolle in unserem täglichen Leben. Vom Kochen und Putzen bis hin zum Autofahren und Heizen – die Chemie ist überall dabei. Ich hoffe, dieser kleine Einblick hat Ihnen geholfen, die Welt um Sie herum mit neuen Augen zu sehen. Genießen Sie Ihren Aufenthalt in Deutschland und entdecken Sie die faszinierende Welt der Chemie, die uns jeden Tag begleitet!

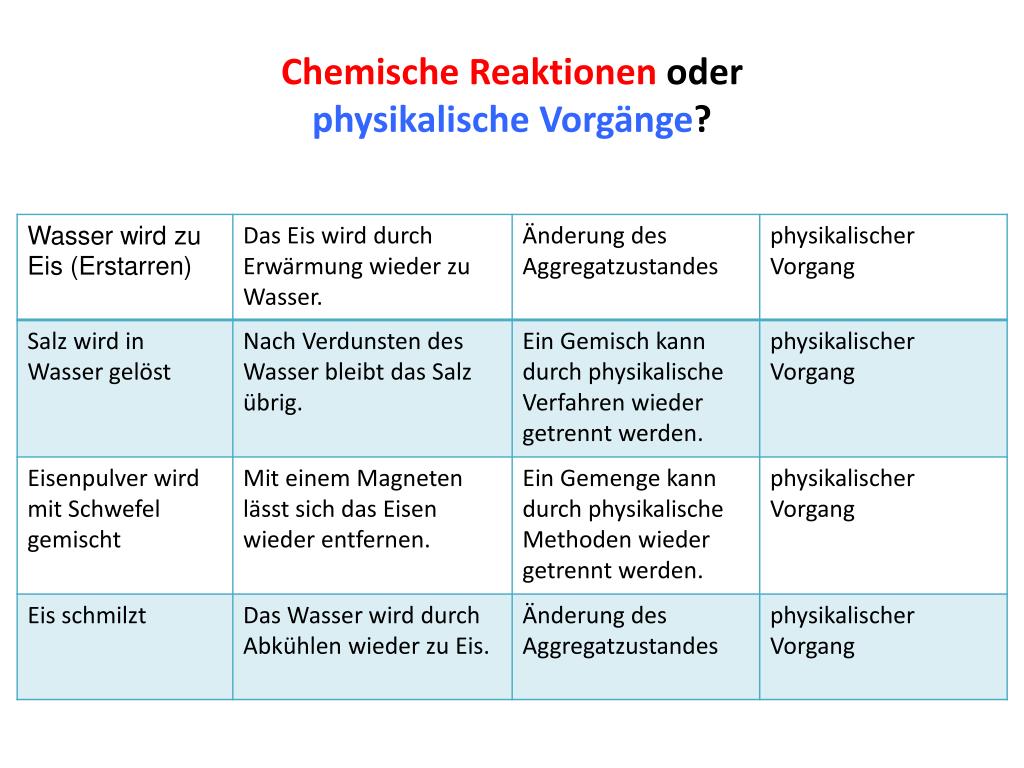











![Beispiele Für Chemische Reaktionen Im Alltag Chemische Reaktion • Merkmale, Redoxreaktionen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/11/Chemische-Reaktion_Physikalischer_Vorgang_WP_1-1-1024x576.jpg)