Reaktionsgleichung Von Aluminium Und Sauerstoff
Hallo liebe Reisefreunde! Heute entführe ich euch mal auf eine ganz besondere Reise. Keine Sorge, wir packen nicht die Koffer, sondern begeben uns auf eine mikroskopische Expedition, eine Entdeckungstour in die Welt der Chemie. Keine Angst, es wird nicht trocken und langweilig, versprochen! Ich möchte euch nämlich von einer Reaktion erzählen, die uns im Alltag ständig begleitet, auch wenn wir sie nicht bewusst wahrnehmen: die Reaktionsgleichung von Aluminium und Sauerstoff.
Stellt euch vor, ihr seid auf einer Wanderung in den Bergen. Ihr habt eure leichte, aber robuste Aluminium-Trinkflasche dabei. Die Sonne strahlt, die Luft ist klar und frisch, und ihr genießt die Aussicht. Was ihr vielleicht nicht bedenkt: In diesem Moment, in jeder Sekunde, findet auf der Oberfläche eurer Trinkflasche ein kleines chemisches Wunder statt. Aluminium, das Metall, aus dem eure Flasche ist, reagiert mit dem Sauerstoff in der Luft. Klingt gefährlich? Keine Sorge, ist es nicht! Es ist sogar ziemlich nützlich.
Die Zutaten: Aluminium (Al) und Sauerstoff (O₂)
Bevor wir uns die Reaktionsgleichung genauer anschauen, müssen wir uns die Protagonisten vorstellen: Aluminium (Al) und Sauerstoff (O₂). Aluminium kennen wir alle. Es ist ein silbrig-weißes Metall, das leicht, stabil und vielseitig ist. Deswegen wird es so oft in Flugzeugen, Autos, Verpackungen und eben auch in Trinkflaschen verwendet. Sauerstoff (O₂) ist das Gas, das wir zum Atmen brauchen. Es macht etwa 21% der Luft aus und ist essentiell für fast alle Lebewesen. Er kommt immer paarweise vor, deshalb schreiben wir ihn als O₂.
Das Ergebnis: Aluminiumoxid (Al₂O₃)
Wenn Aluminium und Sauerstoff aufeinander treffen, entsteht eine Verbindung, die wir Aluminiumoxid (Al₂O₃) nennen. Das ist ein farbloses, hartes und sehr beständiges Material. Aber hier kommt der Clou: Das Aluminiumoxid bildet eine hauchdünne Schicht auf der Oberfläche des Aluminiums. Diese Schicht ist so dicht und undurchlässig, dass sie das darunterliegende Aluminium vor weiterer Korrosion schützt. Es ist wie ein natürlicher Schutzschild! Denkt an eure Aluminium-Trinkflasche. Diese dünne Oxidschicht sorgt dafür, dass eure Flasche nicht einfach verrostet oder zerfällt, sondern jahrelang hält.
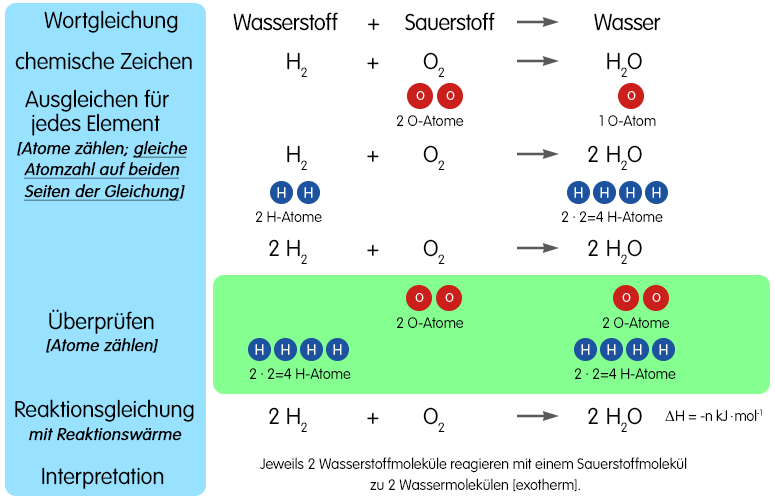
Die Reaktionsgleichung: Das Rezept des Wunders
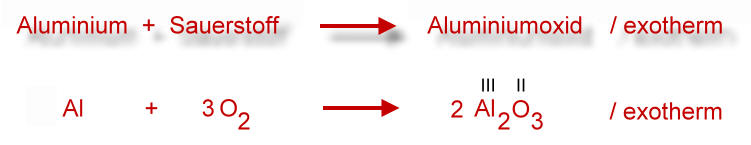
Jetzt kommt der Moment, auf den wir alle gewartet haben: die Reaktionsgleichung. Sie beschreibt, was bei der Reaktion von Aluminium und Sauerstoff passiert, und zwar in der Sprache der Chemie. Die korrekte Reaktionsgleichung lautet:
4 Al + 3 O₂ → 2 Al₂O₃
Was bedeutet das nun genau? Lasst es uns aufdröseln:
- 4 Al: Wir brauchen 4 Atome Aluminium.
- 3 O₂: Diese reagieren mit 3 Molekülen Sauerstoff (also 6 Sauerstoffatomen).
- →: Der Pfeil bedeutet "reagiert zu" oder "ergibt".
- 2 Al₂O₃: Es entstehen 2 Moleküle Aluminiumoxid.
Die Zahlen vor den chemischen Symbolen (4, 3, und 2) sind die sogenannten stöchiometrischen Koeffizienten. Sie stellen sicher, dass die Anzahl der Atome auf beiden Seiten der Gleichung gleich ist. Das ist wichtig, denn bei einer chemischen Reaktion werden keine Atome vernichtet oder neu erschaffen, sondern nur neu angeordnet. Die Reaktionsgleichung ist also wie ein Rezept, das uns genau sagt, welche Mengen an Zutaten wir brauchen, um ein bestimmtes Ergebnis zu erzielen.
Warum ist das so wichtig? Die Passivierung des Aluminiums
Die Bildung der Aluminiumoxidschicht ist ein Phänomen, das als Passivierung bezeichnet wird. Es ist im Grunde eine Selbstschutzmaßnahme des Aluminiums. Diese Schicht ist unglaublich dünn, oft nur wenige Nanometer dick, aber sie ist extrem wirksam. Sie verhindert, dass das Aluminium weiter mit dem Sauerstoff reagiert und somit korrodiert. Ohne diese Passivierung würde Aluminium in feuchter Umgebung schnell rosten und zerfallen, ähnlich wie Eisen.
Denkt an die zahlreichen Bauwerke, Brücken und Flugzeuge, die aus Aluminium gefertigt sind. Die Langlebigkeit dieser Strukturen verdanken wir dieser unsichtbaren Schutzschicht. Auch in der Lebensmittelindustrie wird Aluminium häufig verwendet, beispielsweise in Getränkedosen oder Folien. Die Oxidschicht sorgt dafür, dass das Aluminium nicht mit den Lebensmitteln reagiert und diese verunreinigt.
Ein paar Experimente für zu Hause (Achtung: Sicherheit geht vor!)
Wenn ihr jetzt neugierig geworden seid und das Ganze mal etwas "sichtbarer" machen wollt, hier ein paar Ideen für Experimente (aber bitte immer unter Aufsicht von Erwachsenen und mit den nötigen Sicherheitsvorkehrungen!):
* Eloxieren von Aluminium: Das Eloxieren ist ein Verfahren, bei dem die Aluminiumoxidschicht künstlich verdickt wird. Das Ergebnis ist eine noch widerstandsfähigere Oberfläche, die auch eingefärbt werden kann. Es gibt spezielle Eloxier-Kits für den Heimgebrauch, aber Vorsicht, hierbei werden Chemikalien verwendet! * Beobachtung von Aluminiumfolie in verschiedenen Umgebungen: Legt ein Stück Aluminiumfolie in ein Glas Wasser, ein anderes in ein Glas Salzwasser und ein drittes an die Luft. Beobachtet, was in den nächsten Tagen passiert. Ihr werdet feststellen, dass die Folie im Salzwasser schneller reagiert als im normalen Wasser oder an der Luft. Das liegt daran, dass Salzwasser die Korrosion beschleunigt. * Thermitschweißung (nur für Profis!): Die Thermitschweißung ist ein Verfahren, bei dem Aluminium mit Eisenoxid reagiert. Dabei entstehen sehr hohe Temperaturen, die zum Schweißen verwendet werden können. Dieses Experiment ist gefährlich und sollte nur von erfahrenen Personen durchgeführt werden!Fazit: Ein unsichtbares Wunder, das uns überall begleitet
Die Reaktion von Aluminium und Sauerstoff ist ein faszinierendes Beispiel dafür, wie Chemie unseren Alltag beeinflusst. Obwohl wir sie meist nicht bewusst wahrnehmen, ist sie allgegenwärtig und spielt eine wichtige Rolle für die Langlebigkeit von vielen Produkten, die wir täglich benutzen. Das nächste Mal, wenn ihr eure Aluminium-Trinkflasche in der Hand haltet oder in einem Flugzeug sitzt, denkt daran: Da findet gerade ein kleines chemisches Wunder statt, das euch schützt und eure Reise sicherer macht! Und wer weiß, vielleicht inspiriert euch diese kleine chemische Reise ja sogar zu weiteren Entdeckungen und Abenteuern in der Welt der Wissenschaft. Bis zum nächsten Mal, liebe Reisefreunde! Bleibt neugierig und erkundet die Welt – im Großen wie im Kleinen!



![Reaktionsgleichung Von Aluminium Und Sauerstoff Redoxreaktionen · aufstellen und Beispiel · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2018/12/WP-Bild_Gesamtreaktion-der-Redoxreaktion-1024x576.jpg)