Redoxreaktion übungen Klasse 10 Mit Lösungen

Redoxreaktionen bilden eine fundamentale Säule des Chemieunterrichts in der 10. Klasse. Sie verbinden scheinbar isolierte Konzepte wie Atomstruktur, Ionenbildung und chemische Reaktionen zu einem kohärenten Gesamtbild. Das Verständnis dieser Reaktionen, bei denen Elektronenübertrag stattfindet, ist nicht nur für das Bestehen von Klausuren essentiell, sondern legt auch das Fundament für weiterführende Studien in Chemie, Biologie und sogar Umweltwissenschaften. Doch wie gelingt es, dieses oft als abstrakt empfundene Thema greifbar und verständlich zu machen? Dieser Artikel soll eine Hilfestellung für Schüler der 10. Klasse bieten, die ihr Wissen im Bereich Redoxreaktionen vertiefen und ihre Fähigkeiten in der Lösung von Aufgaben festigen möchten.
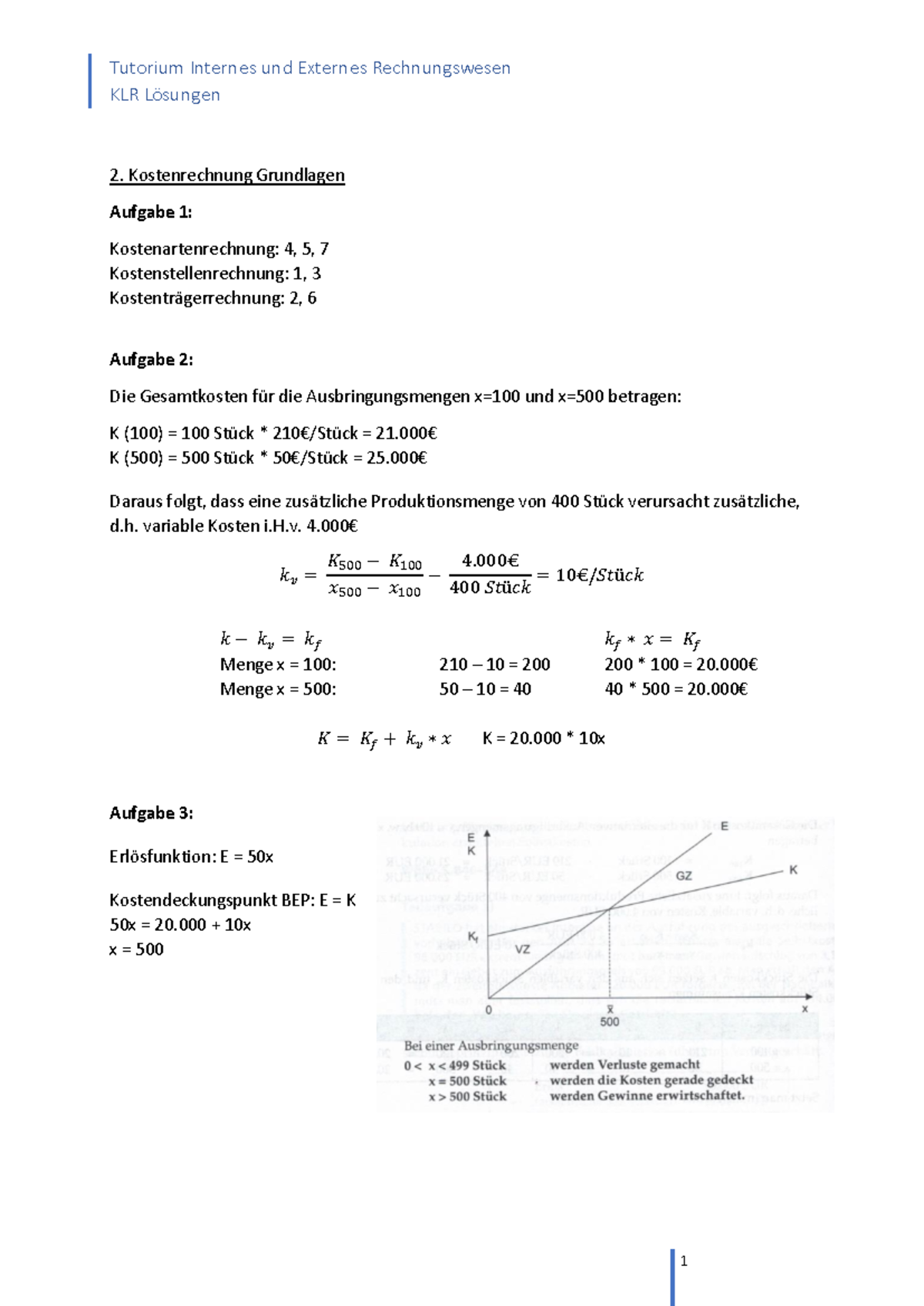
Was sind Redoxreaktionen? Eine Wiederholung der Grundlagen
Bevor wir uns den Übungen zuwenden, ist eine kurze Wiederholung der grundlegenden Konzepte unerlässlich. Eine Redoxreaktion ist, vereinfacht gesagt, eine chemische Reaktion, bei der Elektronen von einem Reaktionspartner auf einen anderen übertragen werden. Dabei finden zwei Teilprozesse gleichzeitig statt: die Oxidation und die Reduktion.
Oxidation und Reduktion: Die zwei Seiten einer Medaille
Die Oxidation ist die Abgabe von Elektronen durch ein Atom, ein Ion oder ein Molekül. Der Stoff, der Elektronen abgibt, wird oxidiert. Dabei erhöht sich seine Oxidationszahl. Merken kann man sich das mit der Eselsbrücke: Oxidation ist Elektronenabgabe (OE). Ein Beispiel hierfür ist die Reaktion von Magnesium mit Sauerstoff: Magnesium gibt Elektronen ab und wird zu Magnesium-Ionen (Mg2+).
Die Reduktion ist die Aufnahme von Elektronen durch ein Atom, ein Ion oder ein Molekül. Der Stoff, der Elektronen aufnimmt, wird reduziert. Dabei verringert sich seine Oxidationszahl. Als Eselsbrücke: Reduktion ist Elektronenaufnahme (RE). Im obigen Beispiel nimmt Sauerstoff Elektronen auf und wird zu Sauerstoff-Ionen (O2-).
Oxidationsmittel und Reduktionsmittel: Die Akteure der Redoxreaktion
Der Stoff, der Elektronen aufnimmt und damit einen anderen Stoff oxidiert, wird als Oxidationsmittel bezeichnet. Im obigen Beispiel ist Sauerstoff das Oxidationsmittel. Umgekehrt ist der Stoff, der Elektronen abgibt und damit einen anderen Stoff reduziert, das Reduktionsmittel. Magnesium ist in diesem Fall das Reduktionsmittel.
Oxidationszahlen: Ein Hilfsmittel zur Identifizierung von Redoxreaktionen
Die Oxidationszahl ist eine formale Ladung, die einem Atom in einer chemischen Verbindung zugewiesen wird. Sie dient dazu, den Elektronenübergang in Redoxreaktionen zu verfolgen. Die Regeln zur Bestimmung von Oxidationszahlen sind essentiell für das Verständnis und die Bilanzierung von Redoxreaktionen. Einige wichtige Regeln sind:
- Die Oxidationszahl eines Elements im elementaren Zustand ist 0 (z.B. O2, Cu, Fe).
- Die Oxidationszahl eines einatomigen Ions entspricht seiner Ladung (z.B. Na+ hat die Oxidationszahl +1, Cl- hat die Oxidationszahl -1).
- Sauerstoff hat in der Regel die Oxidationszahl -2 (Ausnahmen: Peroxide, OF2).
- Wasserstoff hat in der Regel die Oxidationszahl +1 (Ausnahme: Metallhydride).
- Die Summe der Oxidationszahlen aller Atome in einem Molekül oder Ion entspricht der Gesamtladung.
Übungen zu Redoxreaktionen: Von einfach bis komplex
Nun kommen wir zum Kern des Themas: den Übungen. Die folgenden Beispiele sind nach Schwierigkeitsgrad gestaffelt und sollen das Verständnis und die Anwendung der Konzepte vertiefen.
Übung 1: Identifizierung von Redoxreaktionen
Aufgabe: Bestimmen Sie, ob es sich bei den folgenden Reaktionen um Redoxreaktionen handelt. Geben Sie gegebenenfalls Oxidations- und Reduktionsmittel an.
- 2 Mg (s) + O2 (g) → 2 MgO (s)
- HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l)
- Zn (s) + CuSO4 (aq) → ZnSO4 (aq) + Cu (s)
- AgNO3 (aq) + NaCl (aq) → AgCl (s) + NaNO3 (aq)
Lösung:
- Redoxreaktion. Magnesium wird oxidiert (Oxidationszahl steigt von 0 auf +2), Sauerstoff wird reduziert (Oxidationszahl sinkt von 0 auf -2). Magnesium ist das Reduktionsmittel, Sauerstoff ist das Oxidationsmittel.
- Keine Redoxreaktion. Die Oxidationszahlen aller Atome bleiben unverändert. Es handelt sich um eine Neutralisationsreaktion.
- Redoxreaktion. Zink wird oxidiert (Oxidationszahl steigt von 0 auf +2), Kupfer wird reduziert (Oxidationszahl sinkt von +2 auf 0). Zink ist das Reduktionsmittel, Kupfer(II)-sulfat ist das Oxidationsmittel.
- Keine Redoxreaktion. Die Oxidationszahlen aller Atome bleiben unverändert. Es handelt sich um eine Fällungsreaktion.
Übung 2: Bestimmung von Oxidationszahlen
Aufgabe: Bestimmen Sie die Oxidationszahlen aller Atome in den folgenden Verbindungen:
- KMnO4
- H2SO4
- Cr2O72-
- NH4+
Lösung:
- KMnO4: K = +1, Mn = +7, O = -2
- H2SO4: H = +1, S = +6, O = -2
- Cr2O72-: Cr = +6, O = -2
- NH4+: N = -3, H = +1
Übung 3: Aufstellen von Redoxgleichungen
Aufgabe: Stellen Sie die folgenden Redoxreaktionen vollständig auf und gleichen Sie sie aus (sowohl die Massen als auch die Ladungen):
- Fe2+ (aq) + MnO4- (aq) → Fe3+ (aq) + Mn2+ (aq) (im Sauren)
- Cu (s) + HNO3 (aq) → Cu2+ (aq) + NO2 (g) + H2O (l)
Lösung:
-
Schritte zur Lösung:
- Teilgleichungen aufstellen:
- Oxidation: Fe2+ → Fe3+
- Reduktion: MnO4- → Mn2+
- Teilgleichungen ausgleichen:
- Oxidation: Fe2+ → Fe3+ + e-
- Reduktion: MnO4- + 8 H+ + 5 e- → Mn2+ + 4 H2O
- Elektronenanzahl angleichen:
- Oxidation: 5 Fe2+ → 5 Fe3+ + 5 e-
- Reduktion: MnO4- + 8 H+ + 5 e- → Mn2+ + 4 H2O
- Teilgleichungen addieren:
- 5 Fe2+ (aq) + MnO4- (aq) + 8 H+ (aq) → 5 Fe3+ (aq) + Mn2+ (aq) + 4 H2O (l)
- Teilgleichungen aufstellen:
-
Schritte zur Lösung:
- Teilgleichungen aufstellen:
- Oxidation: Cu → Cu2+
- Reduktion: HNO3 → NO2
- Teilgleichungen ausgleichen:
- Oxidation: Cu → Cu2+ + 2 e-
- Reduktion: HNO3 + H+ + e- → NO2 + H2O
- Elektronenanzahl angleichen:
- Oxidation: Cu → Cu2+ + 2 e-
- Reduktion: 2 HNO3 + 2 H+ + 2 e- → 2 NO2 + 2 H2O
- Teilgleichungen addieren:
- Cu (s) + 2 HNO3 (aq) + 2 H+ (aq) → Cu2+ (aq) + 2 NO2 (g) + 2 H2O (l)
- Gesamt: Cu (s) + 4 HNO3 (aq) → Cu2+ (aq) + 2 NO2 (g) + 2 H2O (l)
- Teilgleichungen aufstellen:
Tipps und Tricks für erfolgreiches Üben
Das Lösen von Aufgaben zu Redoxreaktionen erfordert Übung und Geduld. Hier sind einige Tipps, die helfen können:
- Regelmäßig üben: Chemie ist ein Fach, das auf Verständnis und Anwendung basiert. Regelmäßiges Üben ist der Schlüssel zum Erfolg.
- Konzentriert arbeiten: Fehler schleichen sich oft bei unkonzentrierter Arbeit ein. Nehmt euch ausreichend Zeit und arbeitet Schritt für Schritt.
- Aufgaben analysieren: Bevor ihr mit dem Lösen beginnt, lest die Aufgabe sorgfältig durch und identifiziert die relevanten Informationen.
- Übungsgruppen bilden: Gemeinsames Lernen und Diskutieren mit Mitschülern kann das Verständnis vertiefen und neue Perspektiven eröffnen.
- Hilfe suchen: Scheut euch nicht, euren Lehrer oder Tutor um Hilfe zu bitten, wenn ihr Schwierigkeiten habt.
- Fehler analysieren: Wenn ihr eine Aufgabe falsch gelöst habt, versucht, den Fehler zu verstehen und daraus zu lernen.
Fazit
Redoxreaktionen sind ein zentrales Thema im Chemieunterricht der 10. Klasse. Das Verständnis dieser Reaktionen ist nicht nur für das Bestehen von Klausuren wichtig, sondern legt auch das Fundament für weiterführende Studien. Durch regelmäßiges Üben und die Anwendung der oben genannten Tipps und Tricks können Schüler ihre Fähigkeiten in der Lösung von Aufgaben festigen und ein tiefes Verständnis für die Welt der Redoxreaktionen entwickeln. Die Übungen in diesem Artikel bieten einen guten Ausgangspunkt, um das Gelernte zu festigen und sich auf kommende Herausforderungen vorzubereiten. Bleibt neugierig und viel Erfolg beim Üben!