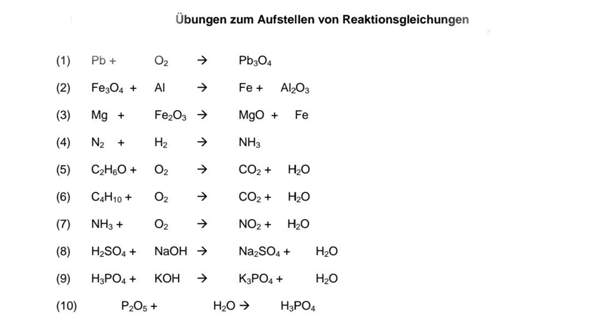
übungen Zum Aufstellen Von Reaktionsgleichungen

Hallo liebe Reisefreunde! Wisst ihr, manchmal führt einen das Leben an die unerwartetsten Orte. Bei mir war das nicht nur ein abgelegenes Bergdorf in Nepal oder eine pulsierende Metropole in Südamerika, sondern – haltet euch fest – die Welt der chemischen Reaktionsgleichungen! Zugegeben, das klingt erstmal nicht nach dem typischen Reiseabenteuer, aber glaubt mir, es kann genauso spannend und befriedigend sein, wenn man es mit der richtigen Einstellung angeht. Ich möchte euch heute mitnehmen auf eine kleine "Reise" zu den Übungen, die mir geholfen haben, das Aufstellen von Reaktionsgleichungen zu meistern. Keine Angst, wir brauchen keine Laborkittel oder Schutzbrillen, nur etwas Neugier und die Bereitschaft, Neues zu entdecken!
Die Zutaten für unsere chemische Reise
Bevor wir uns ins Getümmel stürzen, brauchen wir erstmal die Grundlagen. Stellt euch vor, ihr plant eine Trekkingtour: Ihr braucht Karten, Kompass und natürlich die richtige Ausrüstung. Genauso ist es hier. Wir müssen wissen, was uns erwartet. Die wichtigsten "Ausrüstungsgegenstände" sind:
- Chemische Formeln: Das sind quasi die Straßenschilder in unserer chemischen Welt. Ihr müsst wissen, wie die gängigen Verbindungen geschrieben werden, z.B. Wasser (H2O), Kohlenstoffdioxid (CO2) oder Kochsalz (NaCl). Es gibt unzählige Ressourcen online und in Büchern, die euch dabei helfen können. Denkt daran, Übung macht den Meister!
- Valenzen: Das ist die "Bindungsfähigkeit" eines Atoms. Stellt euch vor, jedes Atom hat eine bestimmte Anzahl an Händen, mit denen es andere Atome festhalten kann. Sauerstoff hat z.B. zwei Hände (Valenz 2), Wasserstoff hat eine (Valenz 1). Das Wissen um die Valenzen hilft uns, die richtigen Formeln zu bilden.
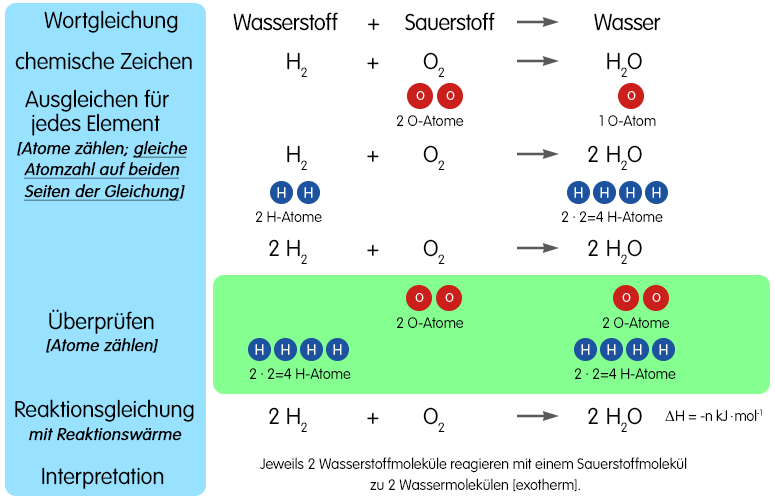
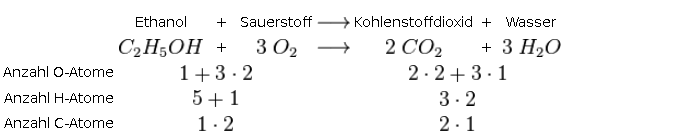
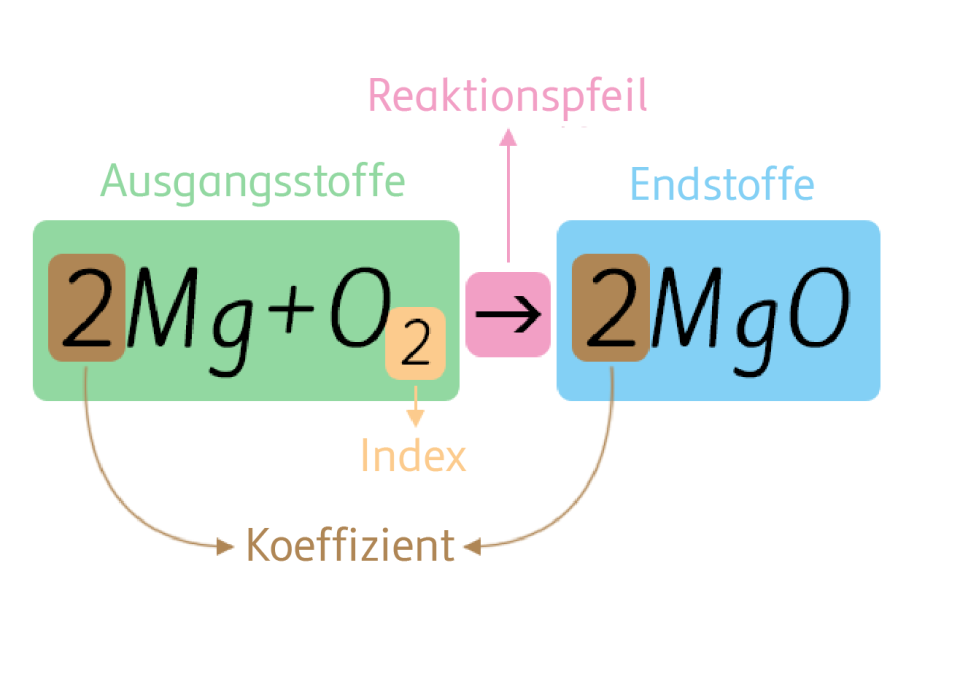
- Das Prinzip der Massenerhaltung: Das ist das wichtigste Gesetz überhaupt! Was reinkommt, muss auch wieder rauskommen. Anders ausgedrückt: Die Anzahl der Atome jedes Elements muss auf beiden Seiten der Reaktionsgleichung gleich sein. Das ist wie beim Packen eures Rucksacks: Alles, was ihr einpackt, müsst ihr auch wieder auspacken (oder zumindest etwas Gleichwertiges).
Übung macht den Meister – Unsere erste Etappe
Okay, die Grundlagen sitzen! Jetzt geht's ans Eingemachte. Wir beginnen mit einfachen Beispielen und steigern uns langsam. Denkt daran, Rom wurde auch nicht an einem Tag erbaut (und eine perfekte Reaktionsgleichung auch nicht!).
Beispiel 1: Die Verbrennung von Methan
Methan (CH4) ist der Hauptbestandteil von Erdgas und verbrennt mit Sauerstoff (O2) zu Kohlenstoffdioxid (CO2) und Wasser (H2O). Die unausgeglichene Gleichung sieht so aus:
CH4 + O2 → CO2 + H2O
Jetzt kommt der spannende Teil: das Ausgleichen! Wir beginnen mit den Kohlenstoffatomen. Auf beiden Seiten haben wir eines, also alles gut. Dann schauen wir uns den Wasserstoff an. Links haben wir vier, rechts nur zwei. Um das auszugleichen, multiplizieren wir das Wasser auf der rechten Seite mit 2:
CH4 + O2 → CO2 + 2 H2O
Jetzt fehlt noch der Sauerstoff. Links haben wir zwei, rechts haben wir 2 (im CO2) + 2 (im 2 H2O) = 4. Also multiplizieren wir den Sauerstoff links mit 2:
CH4 + 2 O2 → CO2 + 2 H2O
Voilà! Die Gleichung ist ausgeglichen. Herzlichen Glückwunsch zur ersten erfolgreichen Etappe!
Beispiel 2: Die Reaktion von Eisen mit Sauerstoff
Eisen (Fe) reagiert mit Sauerstoff (O2) zu Eisen(III)-oxid (Fe2O3). Das ist der klassische Rost. Die unausgeglichene Gleichung:
Fe + O2 → Fe2O3
Diesmal ist es etwas kniffliger. Wir beginnen mit dem Eisen. Rechts haben wir zwei Eisenatome, also multiplizieren wir das Eisen links mit 2:
2 Fe + O2 → Fe2O3
Jetzt der Sauerstoff. Links haben wir zwei, rechts drei. Um das auszugleichen, müssen wir das kleinste gemeinsame Vielfache finden, das ist 6. Also multiplizieren wir den Sauerstoff links mit 3 und das Eisen(III)-oxid rechts mit 2:
2 Fe + 3 O2 → 2 Fe2O3
Jetzt stimmt der Sauerstoff, aber das Eisen nicht mehr! Also müssen wir das Eisen links korrigieren:
4 Fe + 3 O2 → 2 Fe2O3
Geschafft! Auch diese Etappe haben wir erfolgreich gemeistert.
Komplexere Herausforderungen – Unsere zweite Etappe
Jetzt, wo wir die Grundlagen beherrschen, können wir uns an komplexere Aufgaben wagen. Diese erfordern etwas mehr Geduld und strategisches Denken. Aber keine Sorge, mit etwas Übung werdet ihr auch diese Hürden meistern.
Beispiel 3: Die Reaktion von Ammoniak mit Sauerstoff
Ammoniak (NH3) reagiert mit Sauerstoff (O2) zu Stickstoffmonoxid (NO) und Wasser (H2O). Die unausgeglichene Gleichung:
NH3 + O2 → NO + H2O
Hier hilft es, sich zuerst auf die Elemente zu konzentrieren, die in den wenigsten Verbindungen vorkommen. In diesem Fall ist das Stickstoff (N). Auf beiden Seiten haben wir eines, also alles gut. Als nächstes schauen wir uns den Wasserstoff (H) an. Links haben wir drei, rechts zwei. Um das auszugleichen, multiplizieren wir den Ammoniak mit 2 und das Wasser mit 3:
2 NH3 + O2 → NO + 3 H2O
Jetzt haben wir links zwei Stickstoffatome, also müssen wir das Stickstoffmonoxid rechts auch mit 2 multiplizieren:
2 NH3 + O2 → 2 NO + 3 H2O
Jetzt fehlt nur noch der Sauerstoff. Links haben wir zwei, rechts haben wir 2 (im 2 NO) + 3 (im 3 H2O) = 5. Um das auszugleichen, bräuchten wir 2,5 Sauerstoffmoleküle links, was nicht schön ist. Um das zu vermeiden, multiplizieren wir die gesamte Gleichung mit 2:
4 NH3 + 2 O2 → 4 NO + 6 H2O
Fast fertig! Jetzt müssen wir den Sauerstoff wieder korrigieren. Links brauchen wir jetzt 10, also:
4 NH3 + 5 O2 → 4 NO + 6 H2O
Perfekt! Diese Etappe war etwas anspruchsvoller, aber wir haben sie gemeistert!
Tipps und Tricks für eure chemische Reise
Hier sind noch ein paar nützliche Tipps, die euch auf eurer Reise helfen werden:
- Fangt einfach an: Beginnt mit einfachen Gleichungen und steigert euch langsam. Es ist wie beim Wandern: Niemand beginnt gleich mit einer Himalaya-Expedition.
- Nutzt Hilfsmittel: Es gibt viele Online-Rechner und Apps, die euch beim Ausgleichen von Reaktionsgleichungen helfen können. Sie sind wie ein guter Reiseführer.
- Gebt nicht auf: Manche Gleichungen sind wirklich knifflig. Aber lasst euch nicht entmutigen! Übung macht den Meister.
- Versteht die Chemie dahinter: Wenn ihr versteht, *warum* bestimmte Reaktionen ablaufen, wird es euch viel leichter fallen, die Gleichungen aufzustellen. Das ist wie beim Reisen: Wenn ihr die Kultur und Geschichte eines Ortes versteht, werdet ihr ihn viel mehr genießen.
- Macht es zu einem Spiel: Fordert euch selbst heraus, löst Rätsel, oder macht ein Quiz mit Freunden. Das macht das Lernen viel unterhaltsamer.
Ich hoffe, diese kleine "Reise" in die Welt der Reaktionsgleichungen hat euch gefallen und euch geholfen, diese faszinierende Materie besser zu verstehen. Denkt daran, dass das Aufstellen von Reaktionsgleichungen wie eine Sprache ist: Je mehr ihr sie übt, desto fließender werdet ihr darin. Also schnappt euch Stift und Papier, und beginnt eure eigene chemische Entdeckungsreise! Und wer weiß, vielleicht werdet ihr ja auch eines Tages von dieser scheinbar trockenen Materie genauso begeistert sein wie ich. Viel Erfolg und gute Reise!





![übungen Zum Aufstellen Von Reaktionsgleichungen Reaktionsgleichung · Reaktionsschema aufstellen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2020/04/Reaktionsgleichung-Reaktionsschema-1-1024x576.png)