Wie Heißen Die 8 Hauptgruppen Im Periodensystem
Hallo liebe Reisefreunde! Wisst ihr, manchmal stolpere ich auf meinen Abenteuern über Dinge, die mich total faszinieren, obwohl sie auf den ersten Blick gar nichts mit Reisen zu tun haben. Neulich war ich in einem kleinen Wissenschaftsmuseum in Heidelberg und stand plötzlich vor dem Periodensystem. Ja, genau, dieses Ding aus der Schule, das so kompliziert aussah! Aber anstatt gleich wieder wegzulaufen, habe ich mir gedacht: "Hey, das ist doch wie eine Landkarte der Elemente! Jedes Element ein eigenes kleines Land, mit eigenen Eigenschaften und Besonderheiten." Und wisst ihr was? Es war total spannend! Besonders die Hauptgruppen haben mich in ihren Bann gezogen. Lasst mich euch von meiner kleinen Entdeckungsreise durch die 8 Hauptgruppen im Periodensystem erzählen – ganz ohne komplizierte Formeln, versprochen!
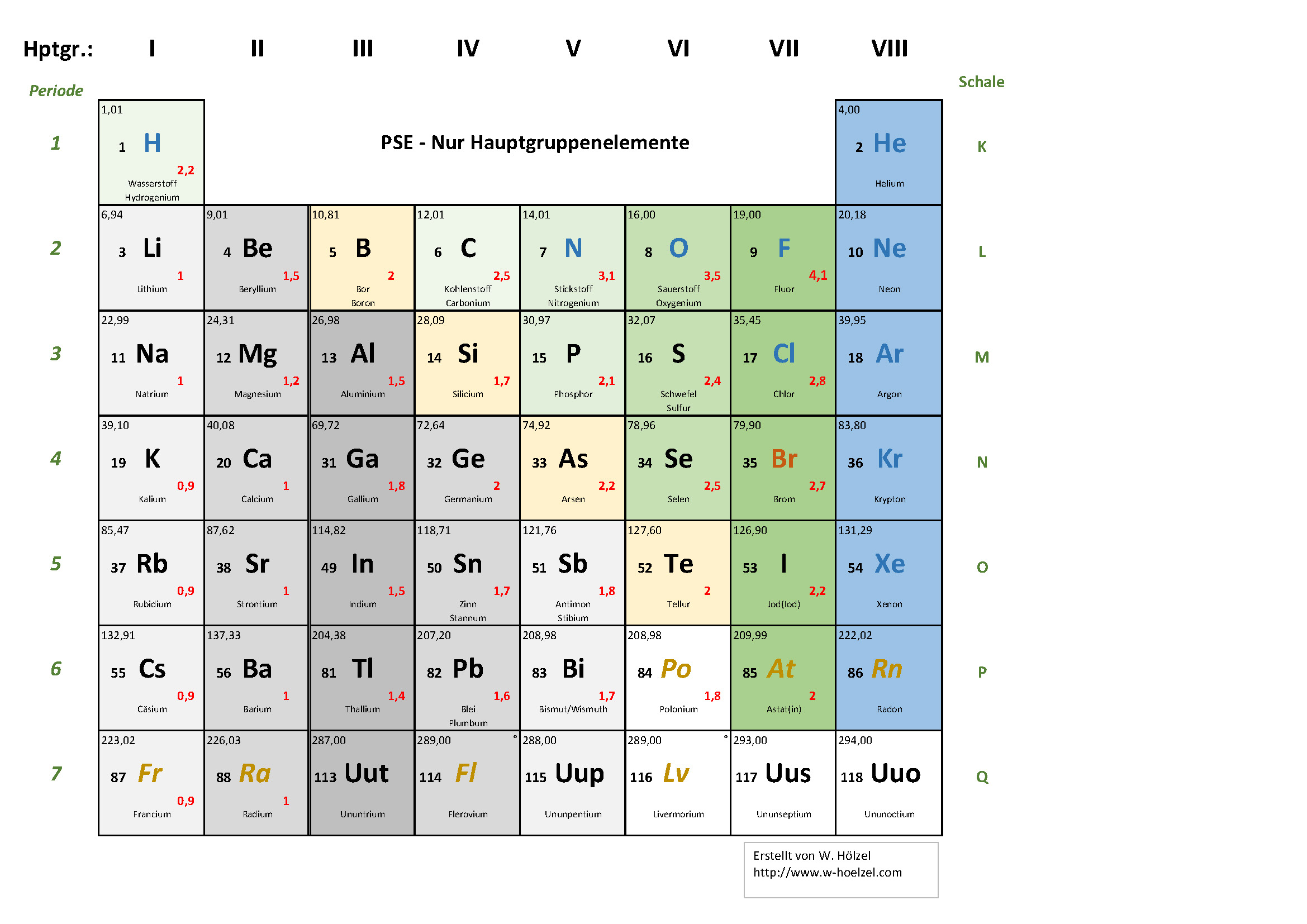
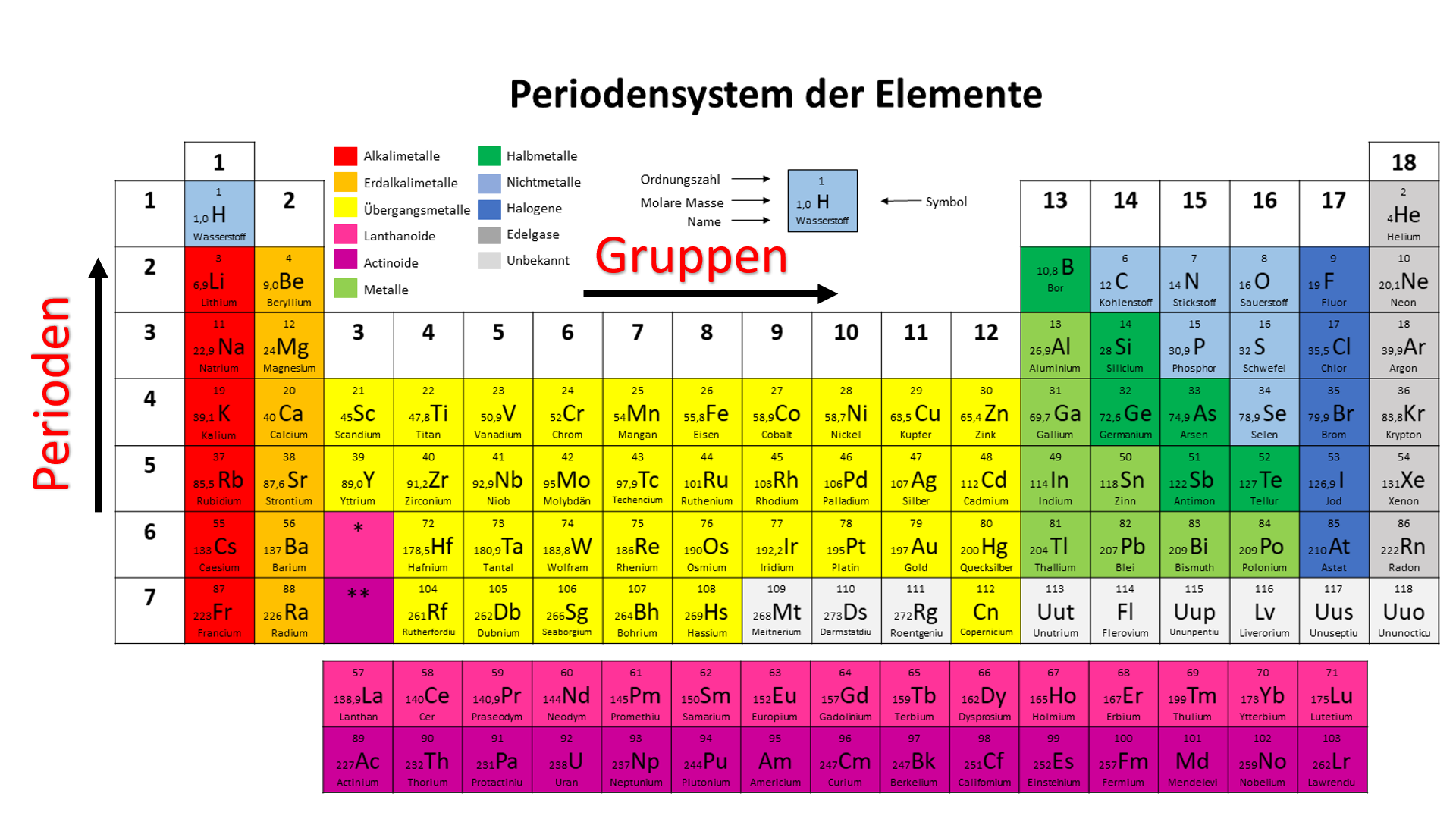
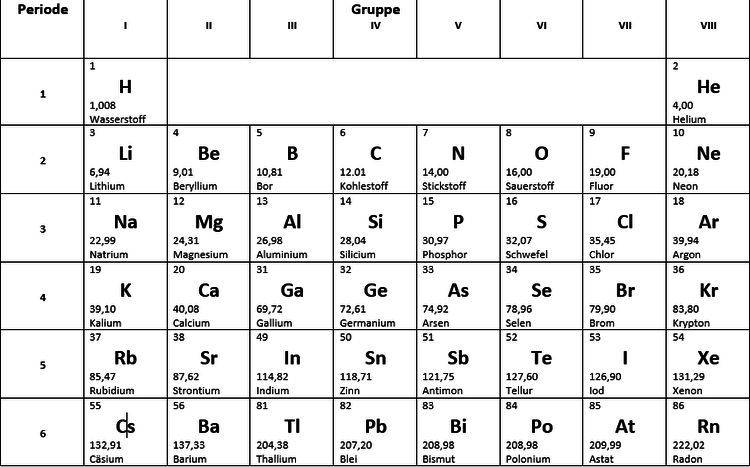
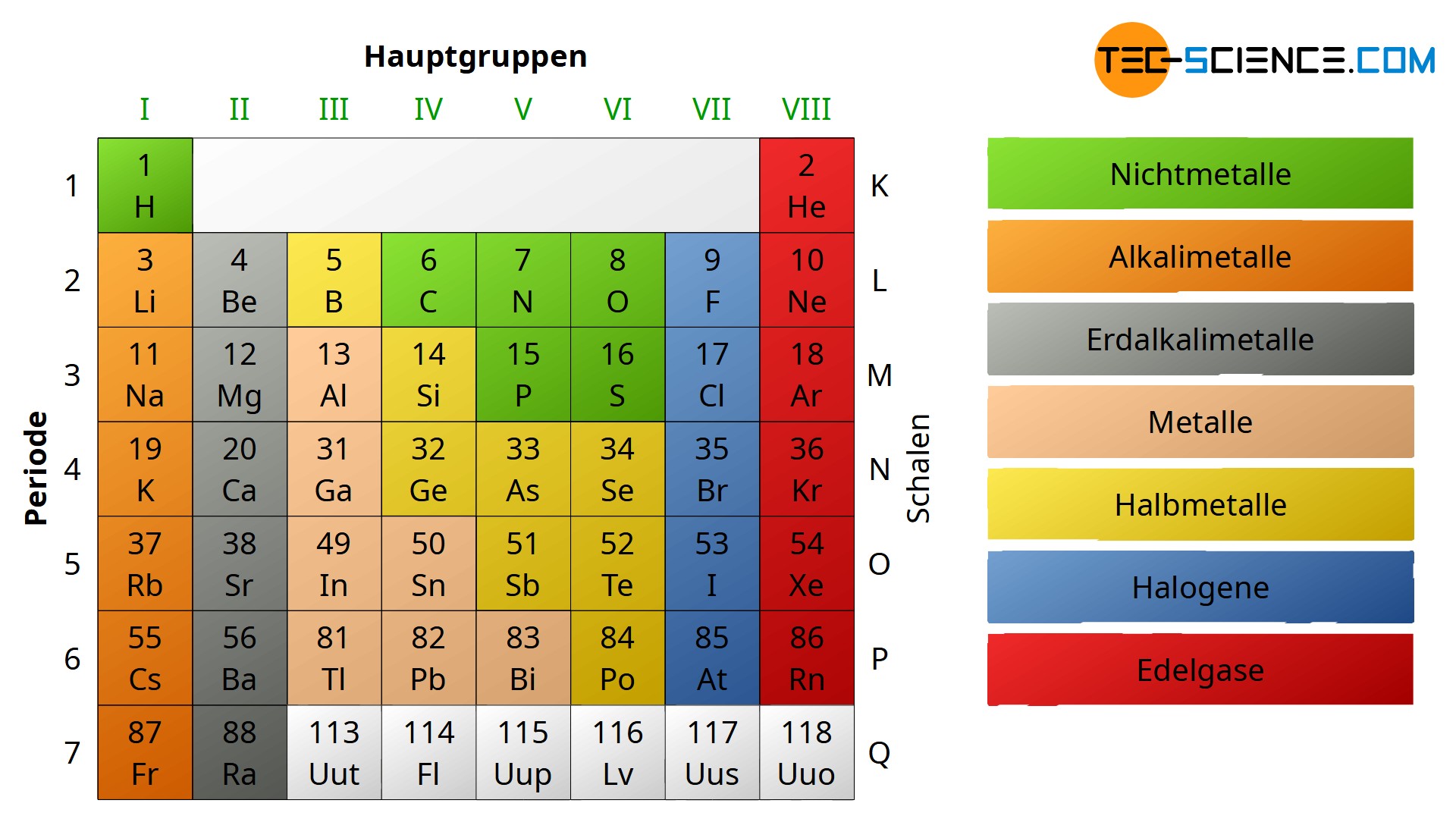
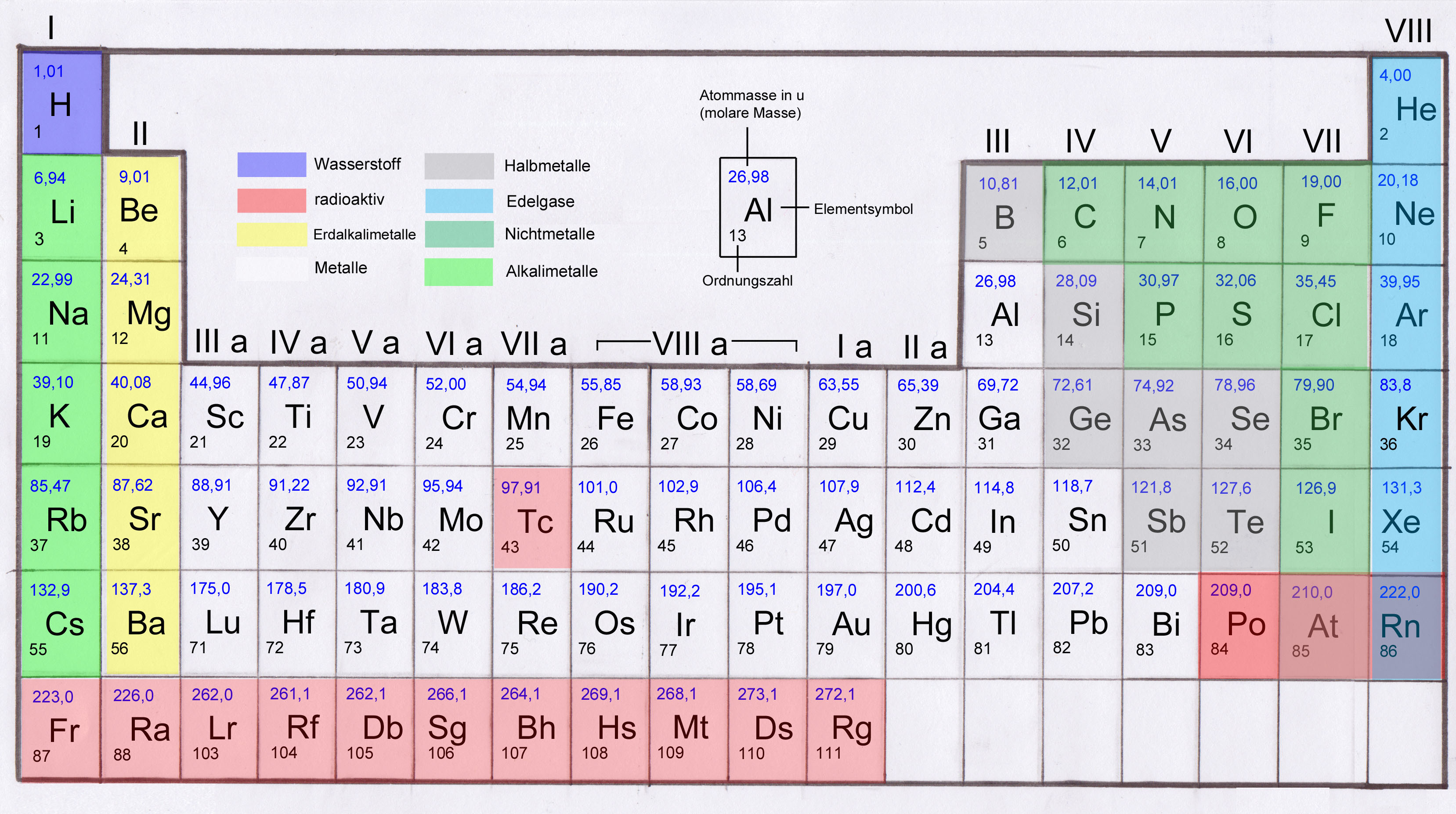
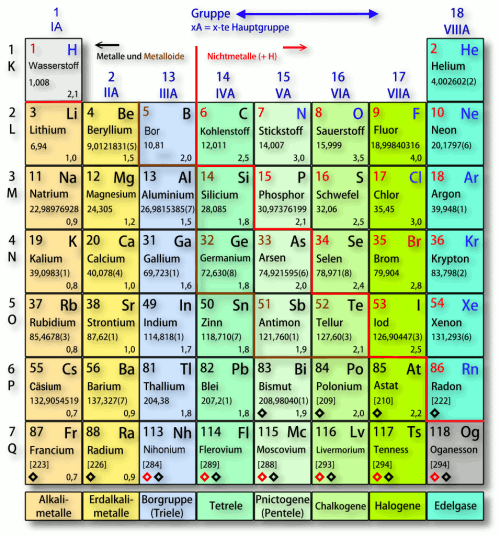
Die 1. Hauptgruppe: Die Alkalimetalle – Explosive Energiebündel!
Stellt euch vor, ihr seid in einem abgelegenen Dorf in Südamerika und entdeckt ein Mineral, das fast von selbst anfängt zu leuchten, sobald es mit Wasser in Berührung kommt. Das wäre vielleicht etwas übertrieben, aber so ähnlich verhalten sich die Alkalimetalle! Diese Gruppe, zu der Elemente wie Lithium (Li), Natrium (Na), Kalium (K), Rubidium (Rb), Cäsium (Cs) und Francium (Fr) gehören, ist bekannt für ihre hohe Reaktivität. Das bedeutet, sie reagieren sehr gerne mit anderen Stoffen, besonders mit Wasser und Luft. Warum? Weil sie nur ein einziges Elektron in ihrer äußersten Schale haben und dieses Elektron gerne loswerden möchten, um stabil zu werden.
Denkt an Natrium, das in unserem Kochsalz steckt. Wenn man reines Natrium in Wasser wirft, gibt es eine heftige Reaktion, bei der Wasserstoffgas entsteht und sich entzünden kann! Kein Wunder, dass diese Metalle unter Öl aufbewahrt werden, damit sie nicht mit der Luftfeuchtigkeit reagieren. Kalium ist übrigens auch superwichtig für unseren Körper, besonders für die Funktion unserer Muskeln und Nerven. Es ist also nicht nur explosiv, sondern auch lebensnotwendig!
Die 2. Hauptgruppe: Die Erdalkalimetalle – Starke Knochen und leuchtende Farben!
Weiter geht die Reise zu den Erdalkalimetallen, zu denen Beryllium (Be), Magnesium (Mg), Calcium (Ca), Strontium (Sr), Barium (Ba) und Radium (Ra) gehören. Diese Gruppe ist etwas weniger reaktiv als die Alkalimetalle, aber immer noch ziemlich aktiv. Sie haben zwei Elektronen in ihrer äußersten Schale, die sie gerne abgeben.
Besonders Calcium ist uns allen bekannt, denn es ist ein wichtiger Baustein für unsere Knochen und Zähne. Aber auch Magnesium spielt eine wichtige Rolle in unserem Körper, zum Beispiel bei der Muskelentspannung. Und Strontium? Das wird in manchen Feuerwerkskörpern verwendet, um eine leuchtend rote Farbe zu erzeugen! Barium hingegen findet Verwendung in der Röntgendiagnostik, wo es als Kontrastmittel eingesetzt wird. Die Erdalkalimetalle sind also nicht nur stark, sondern auch vielseitig!
Die 3. Hauptgruppe: Die Borgruppe – Vom Kochtopf bis zum Halbleiter!
Jetzt wird es etwas bunter! Die Borgruppe, bestehend aus Bor (B), Aluminium (Al), Gallium (Ga), Indium (In) und Thallium (Tl), ist eine Mischung aus Metallen und Halbmetallen. Bor selbst ist ein Halbmetall und wird oft in Glas verwendet, um es hitzebeständiger zu machen (denkt an feuerfeste Auflaufformen!).
Aluminium kennt jeder, denn es ist ein leichtes und stabiles Metall, das in Flugzeugen, Dosen und vielen anderen Dingen verwendet wird. Gallium ist ein besonderes Element, denn es schmilzt schon bei Körpertemperatur! Indium findet Verwendung in Touchscreens und Solarzellen, und Thallium ist giftig, wurde aber früher in Rattengift eingesetzt. Die Borgruppe ist also eine spannende Mischung aus Nützlichem und Gefährlichem!
Die 4. Hauptgruppe: Die Kohlenstoffgruppe – Das Rückgrat des Lebens!
Willkommen in der Welt des Kohlenstoffs! Die Kohlenstoffgruppe, zu der Kohlenstoff (C), Silicium (Si), Germanium (Ge), Zinn (Sn) und Blei (Pb) gehören, ist unglaublich vielfältig. Kohlenstoff ist das Grundelement des Lebens, denn alle organischen Verbindungen basieren auf Kohlenstoffatomen. Es bildet lange Ketten und Ringe und kann sich mit vielen anderen Elementen verbinden.
Silicium ist der Hauptbestandteil von Sand und wird in der Halbleiterindustrie verwendet, um Computerchips herzustellen. Germanium ist ebenfalls ein Halbleiter, während Zinn für die Beschichtung von Konservendosen verwendet wird und Blei früher in Wasserleitungen eingesetzt wurde (was sich aber als keine gute Idee herausstellte, da Blei giftig ist). Die Kohlenstoffgruppe ist also essentiell für unser Leben und unsere Technologie!
Die 5. Hauptgruppe: Die Stickstoffgruppe – Dünger, Sprengstoff und Halbleiter!
Die Stickstoffgruppe, bestehend aus Stickstoff (N), Phosphor (P), Arsen (As), Antimon (Sb) und Bismut (Bi), ist eine weitere bunte Mischung. Stickstoff ist ein wichtiger Bestandteil der Luft, die wir atmen, und wird in der Landwirtschaft als Dünger verwendet. Phosphor ist essentiell für unsere DNA und wird auch in Streichhölzern verwendet.
Arsen ist giftig und wurde früher in Pestiziden eingesetzt, während Antimon in der Halbleiterindustrie und zur Herstellung von schwer entflammbaren Materialien verwendet wird. Bismut ist ein relativ ungiftiges Metall, das in manchen Medikamenten und Kosmetika eingesetzt wird. Die Stickstoffgruppe ist also vielseitig und hat sowohl positive als auch negative Seiten.
Die 6. Hauptgruppe: Die Chalkogene – Schwefel, Selen und Sauerstoff!
Jetzt wird es wieder etwas lebenswichtiger! Die Chalkogene, zu denen Sauerstoff (O), Schwefel (S), Selen (Se), Tellur (Te) und Polonium (Po) gehören, spielen eine wichtige Rolle in unserem Leben und unserer Umwelt. Sauerstoff ist natürlich lebensnotwendig, denn wir brauchen ihn zum Atmen. Schwefel ist ein Bestandteil von Proteinen und wird in der Vulkanisation von Gummi verwendet.
Selen ist ein Spurenelement, das für unsere Gesundheit wichtig ist, während Tellur in der Halbleiterindustrie eingesetzt wird. Polonium ist radioaktiv und sehr giftig. Die Chalkogene sind also lebensnotwendig, aber auch potenziell gefährlich.
Die 7. Hauptgruppe: Die Halogene – Salze und Desinfektionsmittel!
Die Halogene, bestehend aus Fluor (F), Chlor (Cl), Brom (Br), Iod (I) und Astat (At), sind sehr reaktionsfreudige Nichtmetalle. Sie bilden leicht Salze mit Metallen (daher der Name "Halogene" = Salzbildner). Fluor wird in Zahnpasta verwendet, um Karies vorzubeugen, während Chlor als Desinfektionsmittel in Schwimmbädern eingesetzt wird.
Brom wird in der chemischen Industrie verwendet, Iod ist essentiell für die Schilddrüse und Astat ist radioaktiv und sehr selten. Die Halogene sind also nützlich, aber auch ätzend und giftig.
Die 8. Hauptgruppe: Die Edelgase – Die coolen Einzelgänger!
Zum Schluss kommen wir zu den Edelgasen, zu denen Helium (He), Neon (Ne), Argon (Ar), Krypton (Kr), Xenon (Xe) und Radon (Rn) gehören. Diese Elemente sind äußerst reaktionsträge, was bedeutet, dass sie kaum mit anderen Stoffen reagieren. Das liegt daran, dass sie eine vollbesetzte äußerste Schale haben und somit sehr stabil sind.
Helium wird für Luftballons und zur Kühlung von Supraleitern verwendet, Neon leuchtet in Leuchtreklamen, Argon wird als Schutzgas beim Schweißen eingesetzt, Krypton und Xenon finden Verwendung in Lampen und Radon ist radioaktiv. Die Edelgase sind also zwar Einzelgänger, aber dennoch sehr nützlich!
So, liebe Reisefreunde, das war meine kleine Reise durch die 8 Hauptgruppen des Periodensystems. Ich hoffe, ich konnte euch zeigen, dass Chemie nicht nur komplizierte Formeln sind, sondern auch eine faszinierende Welt voller spannender Entdeckungen! Und wer weiß, vielleicht schaut ihr das nächste Mal, wenn ihr ein Museum besucht, etwas genauer auf das Periodensystem – es lohnt sich!
Ich finde es faszinierend, wie diese Elemente, die so grundlegend für unsere Welt sind, oft im Verborgenen wirken, aber dennoch einen so großen Einfluss auf unser Leben haben. Es ist wie bei einer Reise: Manchmal sind es die unscheinbaren Details, die den größten Eindruck hinterlassen.



![Wie Heißen Die 8 Hauptgruppen Im Periodensystem Periodensystem Hauptgruppen • Anzahl, Namen · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/12/WP-Bild_Gruppen-im-Periodensystem-2-1024x576.jpg)