Redoxreaktion übungen Mit Lösungen Klasse 8

Hallo liebe Entdecker und Abenteurer! Ich bin's, eure treue Reisebegleiterin, und heute entführe ich euch in eine ganz besondere Welt. Keine Sorge, wir verlassen nicht die Erde, aber wir tauchen tief in die faszinierende Welt der Chemie ein. Genauer gesagt, in die der Redoxreaktionen – und zwar so, dass es sogar für Achtklässler zum spannenden Abenteuer wird! Ja, ihr habt richtig gelesen: Redoxreaktionen, Übungen und Lösungen, verpackt in eine unterhaltsame Geschichte, damit ihr euch nicht fühlt, als wärt ihr in der Schule, sondern auf einer spannenden Entdeckungstour.
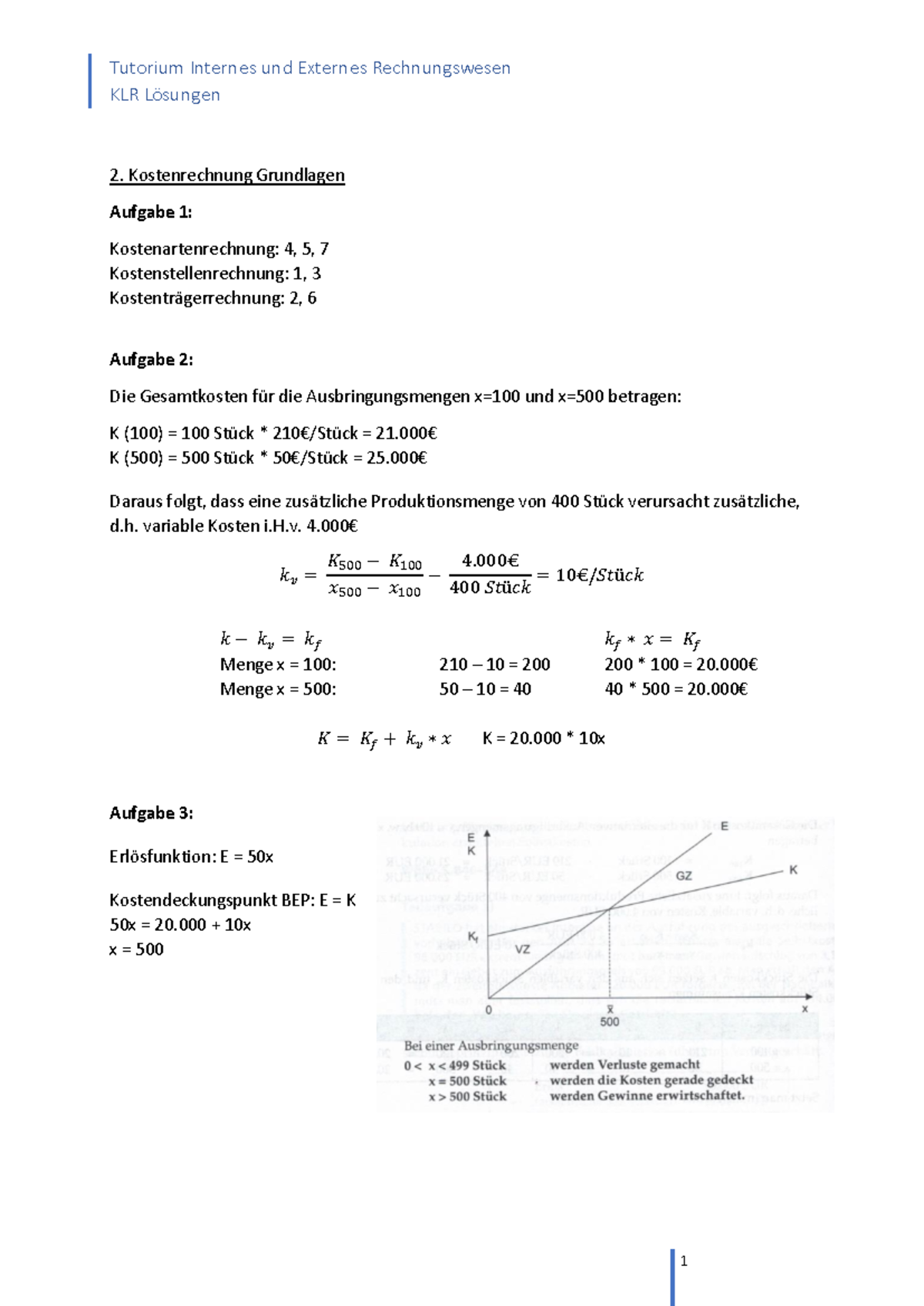
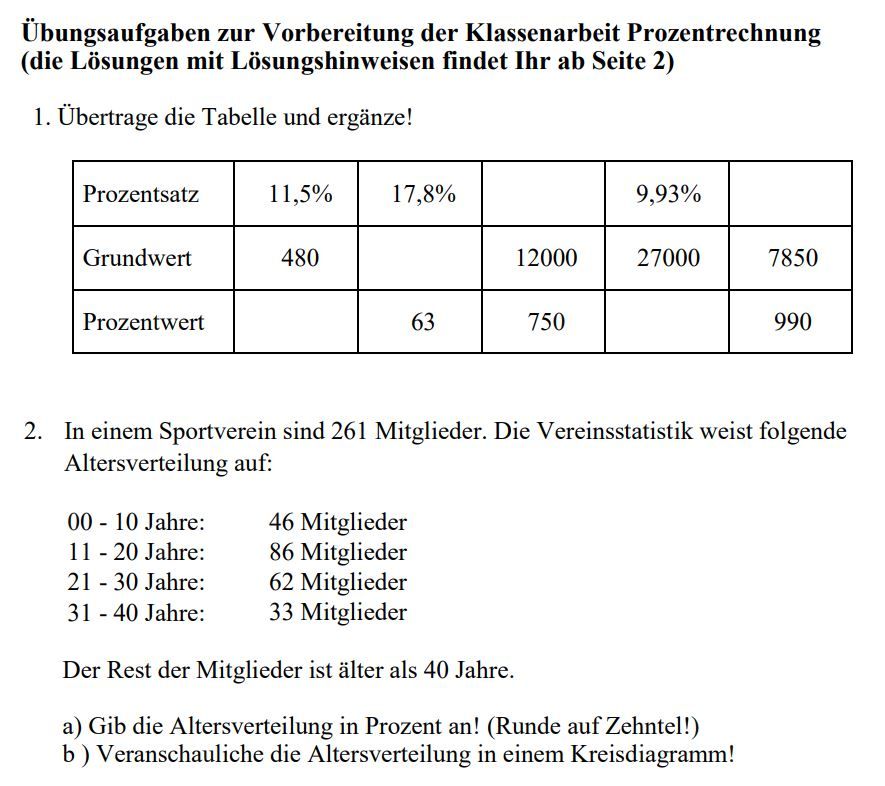
Ich erinnere mich noch gut an meine eigene Schulzeit. Chemie war… nun, sagen wir mal, nicht gerade mein Lieblingsfach. Trockene Formeln, unverständliche Prozesse – es fühlte sich oft an wie eine fremde Sprache. Aber als ich dann die Redoxreaktionen verstanden habe, ging mir ein Licht auf! Plötzlich ergab alles Sinn. Und genau dieses "Aha"-Erlebnis möchte ich euch heute vermitteln.
Was sind Redoxreaktionen überhaupt?
Stellt euch vor, ihr seid auf einer Schatzsuche. Ein Schatz (in unserem Fall Elektronen) wird von einem Piraten (dem Reduktionsmittel) geraubt und einem anderen Piraten (dem Oxidationsmittel) gegeben. Redoxreaktionen sind im Grunde nichts anderes als eine Elektronenübertragung. Der Pirat, der die Elektronen abgibt, wird oxidiert. Der Pirat, der sie aufnimmt, wird reduziert. Klingt kompliziert? Keine Sorge, wir machen es anschaulich!
Denkt an ein Lagerfeuer. Das Holz (Kohlenstoff) reagiert mit dem Sauerstoff in der Luft. Der Kohlenstoff wird oxidiert (er verbindet sich mit Sauerstoff), und der Sauerstoff wird reduziert. Dabei wird Energie in Form von Wärme und Licht freigesetzt. Eine Redoxreaktion im großen Stil! Oder denkt an das Rosten von Eisen. Das Eisen reagiert mit Sauerstoff und Wasser und bildet Eisenoxid (Rost). Wieder eine Redoxreaktion!
Die wichtigsten Begriffe auf einen Blick:
- Oxidation: Abgabe von Elektronen (Oxidationszahl wird größer)
- Reduktion: Aufnahme von Elektronen (Oxidationszahl wird kleiner)
- Redoxreaktion: Eine Reaktion, bei der gleichzeitig eine Oxidation und eine Reduktion stattfindet
- Oxidationsmittel: Nimmt Elektronen auf und wird dabei reduziert
- Reduktionsmittel: Gibt Elektronen ab und wird dabei oxidiert
Übungen für kleine Chemiker:
Jetzt wird's interaktiv! Hier sind ein paar Übungen, die ihr selbst ausprobieren könnt. Keine Angst, ihr braucht kein Chemielabor, sondern nur ein bisschen Neugier und vielleicht ein paar Küchenutensilien.
Übung 1: Die Zitrone als Batterie
Habt ihr schon mal von einer Zitronenbatterie gehört? Das ist eine tolle Möglichkeit, Redoxreaktionen in Aktion zu erleben! Ihr braucht:
- Eine Zitrone
- Eine Kupfermünze (z.B. ein 1- oder 2-Cent-Stück)
- Eine verzinkte Schraube oder einen Nagel
- Kabel mit Krokodilklemmen
- Ein Multimeter (optional, aber hilfreich)
So geht's: Schneidet zwei kleine Schlitze in die Zitrone. Steckt die Kupfermünze in einen Schlitz und die verzinkte Schraube in den anderen. Verbindet die Münze und die Schraube mit den Kabeln. Wenn ihr ein Multimeter habt, könnt ihr die Spannung messen, die die Zitrone erzeugt. Die Kupfermünze wirkt als Kathode (positive Elektrode), und die verzinkte Schraube als Anode (negative Elektrode). Durch die chemische Reaktion zwischen dem Zitronensaft und den Metallen werden Elektronen freigesetzt, die einen Stromfluss erzeugen.
Übung 2: Die Verfärbung des Apfels
Kennt ihr das, wenn ein aufgeschnittener Apfel braun wird? Auch das ist eine Redoxreaktion! Die Enzyme im Apfel reagieren mit dem Sauerstoff in der Luft. Um das zu verhindern, könnt ihr den Apfel mit Zitronensaft beträufeln. Der Zitronensaft enthält Ascorbinsäure (Vitamin C), ein starkes Reduktionsmittel, das die Oxidation verhindert.
Übung 3: Silber putzen mit Backpulver
Angelaufenes Silberbesteck? Kein Problem! Auch hier kann uns eine Redoxreaktion helfen. Ihr braucht:
- Angelaufenes Silberbesteck
- Eine Schüssel
- Alufolie
- Backpulver
- Heißes Wasser
So geht's: Legt die Alufolie in die Schüssel. Gebt das Silberbesteck darauf, sodass es Kontakt zur Alufolie hat. Fügt ein paar Esslöffel Backpulver hinzu und gießt heißes Wasser über das Ganze. Lasst es eine Weile einwirken. Die Alufolie wirkt als Reduktionsmittel und überträgt Elektronen auf das Silbersulfid (den schwarzen Belag auf dem Silber), wodurch es sich wieder in metallisches Silber umwandelt.
Lösungen und Erklärungen:
Okay, jetzt kommen wir zu den Lösungen der Übungen. Aber bevor ihr schummelt, versucht es erst selbst! Das Wichtigste ist, dass ihr den Prozess versteht, nicht nur das Ergebnis.
Lösung Übung 1: Die Zitrone als Batterie
Die Zitrone fungiert als Elektrolyt, eine leitfähige Flüssigkeit. Die Zinkatome der verzinkten Schraube geben Elektronen ab und werden zu Zinkionen (Oxidation). Diese Elektronen fließen über das Kabel zur Kupfermünze. An der Kupfermünze reagieren Wasserstoffionen (aus der Zitronensäure) mit den Elektronen und bilden Wasserstoffgas (Reduktion). Die Spannung, die ihr mit dem Multimeter messen könnt, ist ein Beweis für den Elektronenfluss.
Reaktionsgleichungen (vereinfacht):
- Oxidation (an der Zinkelektrode): Zn → Zn2+ + 2e-
- Reduktion (an der Kupferelektrode): 2H+ + 2e- → H2
Lösung Übung 2: Die Verfärbung des Apfels
Die Enzyme Polyphenoloxidase (PPO) im Apfel katalysieren die Reaktion von Polyphenolen mit Sauerstoff. Dabei entstehen braune Melanine. Ascorbinsäure im Zitronensaft wirkt als Reduktionsmittel und wird selbst oxidiert, wodurch die Oxidation der Polyphenole verhindert wird.
Lösung Übung 3: Silber putzen mit Backpulver
Das angelaufene Silberbesteck ist mit Silbersulfid (Ag2S) überzogen. Die Alufolie (Al) ist ein stärkeres Reduktionsmittel als Silber. In der wässrigen Lösung des Backpulvers (Natriumcarbonat, Na2CO3) findet folgende Redoxreaktion statt:
2Al + 3Ag2S + 6H2O → 6Ag + 2Al(OH)3 + 3H2S
Das Aluminium wird oxidiert und bildet Aluminiumhydroxid, während das Silbersulfid reduziert wird und metallisches Silber entsteht. Der Schwefelwasserstoff (H2S) kann einen leichten Geruch verursachen.
Warum sind Redoxreaktionen wichtig?
Redoxreaktionen sind überall um uns herum! Sie sind die Grundlage für viele wichtige Prozesse, wie zum Beispiel:
- Verbrennung: Das Verbrennen von Holz, Gas oder Öl ist eine Redoxreaktion, die Energie freisetzt.
- Atmung: In unseren Zellen werden Nährstoffe durch Redoxreaktionen abgebaut, um Energie zu gewinnen.
- Photosynthese: Pflanzen nutzen die Energie des Sonnenlichts, um Kohlenstoffdioxid und Wasser in Zucker und Sauerstoff umzuwandeln – eine Redoxreaktion!
- Batterien: Batterien nutzen Redoxreaktionen, um elektrische Energie zu erzeugen.
- Korrosion: Das Rosten von Eisen oder das Anlaufen von Silber sind ungewollte Redoxreaktionen.
Mein Fazit: Chemie ist überall!
Ich hoffe, ich konnte euch zeigen, dass Chemie gar nicht so trocken und kompliziert sein muss. Mit ein bisschen Neugier und Kreativität kann man Redoxreaktionen sogar zu einem spannenden Abenteuer machen. Und wer weiß, vielleicht entdeckt ihr ja sogar euer inneres Chemie-Genie! Vergesst nicht: Das Wichtigste ist, Fragen zu stellen, auszuprobieren und Spaß zu haben!
Also, liebe Abenteurer, packt eure Neugierde ein und begebt euch auf eure eigene chemische Entdeckungstour! Ich bin gespannt, welche spannenden Experimente ihr durchführt und welche faszinierenden Erkenntnisse ihr gewinnt. Bis zum nächsten Mal, eure reiselustige Chemikerin!